Microbiota y disbiosis
Al final de este apartado podrás encontrar algunas conclusiones para resumir lo esencial. Gran parte de lo que sabemos sobre la microbiota es especulativo, a diferencia de lo que ocurre en otras líneas de investigación (alteraciones neurológicas e inmunitarias principalmente) donde la investigación está más consolidada. Por eso quizá sea mejor quedarse sólo con lo esencial por el momento, al menos si no eres un investigador.
Para empezar, hablaremos de las bacterias y su influencia en los primeros años de la vida. Luego entraremos en aspectos específicos de la microbiota en el SII, entrando en algunas controversias acerca de la dieta low FODMAP. Posteriormente, hablaremos de la fermentación. Y en un apartado final veremos por encima la forma en que las bacterias pueden comunicarse con el cerebro a través del eje microbiota-intestino-cerebro.
Nos hemos ceñido a las bacterias, pero investigaciones más recientes empiezan a situar al micobioma (las poblaciones de hongos que viven en nuestro intestino) como otro agente importante en el SII. Hay una revisión sobre el tema de 2019, hablando de aspectos generales, pero ya en 2017 se habían encontrado señales de disbiosis fúngica en pacientes con SII al comparar con controles sanos. Un estudio de 2020 mostró cómo las alteraciones de la micobiota podrían ser un biomarcador del SII-D más preciso que las alteraciones de la microbiota intestinal (poblaciones de bacterias en el intestino). Y otro estudio de 2020 mostró cómo los hongos podrían generar síntomas diarreicos en el SII-D al activar a los mastocitos a través de los receptores Dectin-1.
En otros estudios (2020) también se está empezando a hablar del rol del viroma (poblaciones de virus) entérico, al haber encontrado una reducción significativa en la diversidad y abundancia del mismo en pacientes con SII. Sin embargo, por el momento nos ceñiremos a las bacterias.
LAS BACTERIAS Y LOS PRIMEROS AÑOS
Las bacterias tienen un papel fundamental en nuestra vida prácticamente desde el nacimiento. Al nacer, el bebé recibe las bacterias presentes en la flora vaginal y fecal de la madre, y luego seguirá obteniendo sus bacterias mediante la lactancia. Entre estas primeras bacterias que colonizan el cuerpo del bebé, especialmente su intestino, podemos encontrar frecuentemente cepas de Lactobacillus y Bifidobacterium (las mismas que se venden en muchos probióticos, o las que suelen contener los yogures).
Cuando la colonización «normal» de las bacterias en estos primeros meses no es posible, ya sea porque el nacimiento ha sido por cesárea, o porque la lactancia se ha realizado con fórmulas comerciales, o porque la madre ha pasado por tratamientos con antibióticos durante este periodo, hay una mayor probabilidad de desarrollar algunos padecimientos, como enfermedades autoinmunes y metabólicas. Por nombrar unas cuantas, la enfermedad celíaca, el asma, la diabetes tipo 1 y la obesidad están relacionadas con los problemas antes mencionados. Ya hay estudios en marcha donde se desarrollan distintas estrategias para repoblar la flora de estos niños recién nacidos (como los dos de arriba).
La conclusión que podemos sacar de todo ello, dentro del terreno que estamos tratando, es que los defectos en la flora bacteriana en los primeros momentos de la vida son un factor de riesgo para desarrollar, entre otras cosas, futuros problemas digestivos. Sin embargo son necesarios más estudios y con variables mejor controladas (la lactancia por ejemplo no sólo permite al bebé enriquecer su flora intestinal, también es importante para el desarrollo del sistema inmune).
De todas formas, la flora bacteriana no es aún ni mucho menos “estable”, y seguirá desarrollándose y cambiando al menos durante los 3 primeros años (2017).
Con el tiempo, el bebé va creciendo, y querrá llevarse cosas a la boca, tocarlo todo, interactuar con otros niños, con animales…todo lo cual le hará estar en contacto con una variedad aún mayor de microorganismos y bacterias. La higiene va a ser necesaria, pero una limpieza excesiva determinará también el desarrollo de su flora bacteriana. Eso es lo que dice la hipótesis de la higiene, que ha recibido bastante atención en estas enfermedades al verse una mayor prevalencia de SII post-infecciosos (2010) en países más desarrollados como los de Norteamérica o el norte de Europa, en comparación con el resto del mundo (21% VS 14%). En el resto del mundo también hay infecciones, pero estos parásitos no llegan a provocar un síndrome del intestino irritable, probablemente, según defienden estos médicos, porque han estado en contacto con el cuerpo humano desde que éste era todavía pequeño, y la flora bacteriana ha “aprendido” a lidiar o convivir con ellos.
A la vez que el niño chupetea, corretea, y lo va tocando todo allá donde va, también empezará depender menos de la leche materna, y comenzará a comer alimentos sólidos. Una revisión de 2017 observó que, mientras el bebé es aún un lactante, la leche parece mantener a la microbiota en una situación de escasa diversidad, con dominancia de las cepas Bifidobacterium. Pero al empezar a comer sólidos y comidas parecidas a las del resto de la familia, esto trae consigo un aumento de la diversidad, así como de las cepas de las familias Lachnospiraceae y Ruminococcaceae.
Tras estas primeras etapas, la persona ya tiene más o menos definida su microbiota (también referida como microbioma). Pero el funcionamiento de ésta es, a día de hoy, todo un misterio. Para hacernos una idea de la complejidad de su estudio, los genes del conjunto de bacterias que componen la microbiota superan en número a los del genoma humano en una proporción de 100 contra 1, y su influencia en los procesos fisiológicos de nuestro cuerpo es tal que la microbiota ha sido reconocida como un órgano más del mismo (2012).
Los avances en los métodos diagnósticos, la prevalencia de trastornos funcionales digestivos como el SII (es decir, problemas digestivos sin causa aparente), el auge de los probióticos y su eficacia en casos puntuales (menos de los que uno podría pensar), así como los vínculos con diferentes enfermedades que hemos ido observando, o teorías como la de la hipótesis de la higiene, han ayudado a que se preste cada vez más atención a este campo. Otro dato interesante que el 3% de nuestro peso corporal está integrado por las bacterias que tenemos (de media, unos 2 kilos de un cuerpo humano son bacterias), y normalmente un 30% de nuestras heces está formado por restos de bacterias muertas, pues éstas se reproducen y mueren constantemente (enciclopedia Britannica, 2020). Se ha llegado a demostrar incluso que una enfermedad del desarrollo como el autismo está muy relacionada con ciertos aspectos de la microbiota: en un estudio de 2018, destacado por Nature, se desarrolló una prueba diagnóstica en la que, observando algunos microbios clave de la saliva, se puede diagnosticar un Trastorno del Espectro Autista con un 96.3% de precisión. Como venimos diciendo desde el principio, la microbiota está en todas partes. Queda por saber cuál es su papel en los trastornos funcionales digestivos como el SII.
LA MICROBIOTA EN EL SII
Hay señales bastante evidentes de que la microbiota juega un papel en el SII. El éxito (aunque todavía controvertido) de algunos probióticos en mejorar determinados síntomas, el riesgo aumentado de desarrollar el trastorno en el futuro por la exposición a antibióticos (2012, 2013, 2015, web de la IFFGD), o los resultados favorables (aunque generalmente transitorios) en algunos casos de SII-D con el antibiótico rifaximina (2016), todos estos son datos que vienen a reforzar lo que ya sabemos: hay que empezar a poner el foco en la microbiota.
Ya hemos dicho que hay estudios en los que, con lo poco que sabemos hasta la fecha de microbiota, se observan diferencias entre pacientes con intestino irritable y personas sanas. En la siguiente imagen, extraída de un estudio de 2015 del «American Journal of Gastroenterology», pueden verse las cepas bacterianas que más difieren entre unos y otros, la mayoría de las cuales están marcadas con flechas hacia arriba (los SII las tienen en demasía) o hacia abajo (los SII las tienen disminuidas). Si la flecha aparece al lado de la letra D, significa que en los casos con predominio de diarrea está de una manera, para diferenciar de los casos con predominio de estreñimiento, con la letra C. Fijaos sobre todo en las que están en negrita, pues son las que han sido confirmadas en al menos dos estudios independientes.
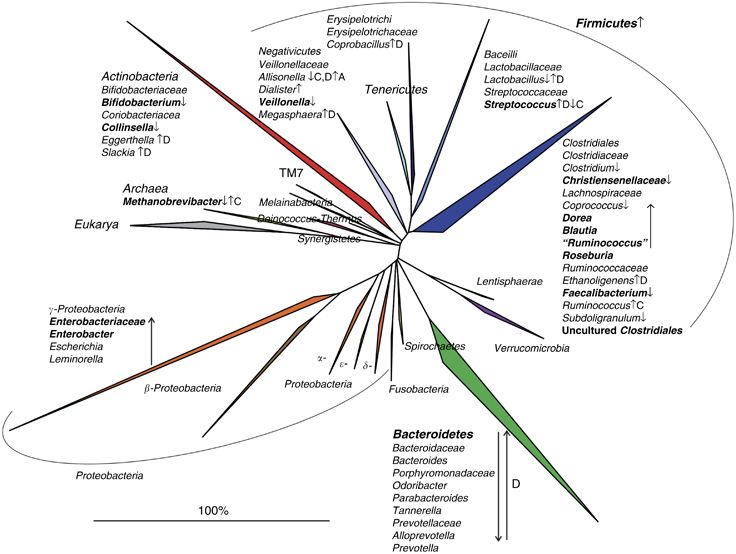
Pero, ¿significa esto que con meter las cepas que faltan, y usar un antibiótico específico para las que sobran, ya está todo solucionado? Pues, por desgracia, no. Puede que existan 100 veces más cepas de las que conocemos a día de hoy, y aún no se sabe con exactitud cómo interactúan entre ellas o con otros órganos, por lo que los tratamientos en esta línea pueden volverlo a uno loco. Igual erradico X, que me va mal, pero…resulta que X en realidad está relacionada con la síntesis de Z, que a su vez mantiene a raya a Y…y ahora la población de Y se dispara, y me da otros problemas. O a lo mejor X no es tan «malo» como yo pensaba y tiene propiedades que me interesan.
Y no solamente eso, por lo que se ve a día de hoy, no existen dos microbiotas iguales, aunque se vean ciertos patrones “vagos” en personas sanas. Y la microbiota también se relaciona y cambia al contacto con los genes, con la dieta…es un tema muy complejo y hará falta muchísima investigación para poderlo esclarecer.
En la actualidad, el SII y los trastornos funcionales digestivos se diagnostican por síntomas, un método diagnóstico que no acaba de convencer ni a los médicos (un mismo síntoma puede tener cientos de causas diferentes) ni a los pacientes (que ven demasiada heterogeneidad entre unos casos y otros, y sufren de una falta absoluta de certezas al enfrentarse con la enfermedad). Han habido intentos de hacer clasificaciones del SII alternativas a las de Roma o Manning (esta última no se utiliza en la actualidad, pero también se basaba en una serie de síntomas característicos).
En un estudio de 2012, los autores realizaron un experimento en el que dividieron a pacientes de SII en 2 grupos, los que tenían una microbiota alterada, y los que no. En este segundo grupo, donde la microbiota era «normal», había una mayor prevalencia de factores de riesgo psicológicos, lo que apunta a distintos subtipos de intestino irritable, con distintos factores predominantes (disbiosis en un caso y alteraciones psicológicas en el otro). De todas formas, hay que coger con pinzas este estudio por varios motivos. Primero, es solo un estudio, tendría que ser replicado para consolidar este hallazgo. Segundo, los hallazgos no implican que las alteraciones en la microbiota o en la psique sean las que provoquen el SII, sólo que se asocian a él. Y tercero, aún no sabemos prácticamente nada sobre microbiota, no podemos siquiera definir la eubiosis, mucho menos la disbiosis.
En 2016, otro estudio intentó diferenciar la microbiota en distintos niveles de gravedad del SII, separados en: sujetos sanos, síntomas leves/moderados, y síntomas graves. Los síntomas eran peores cuanto menor fuera la riqueza microbiana (diversidad), el metano espirado, la presencia de metanógenos, y los enterotipos enriquecidos con las cepas Clostridiales o Prevotella. La muestra en la fase de validación del test fue de 46 personas, por lo que los resultados no se pueden extrapolar demasiado, pero es un hallazgo interesante.
Y en 2020, un estudio dividió a pacientes con SII en dos grupos. El primero tenía una microbiota muy similar a la de sujetos sanos, y el segundo tenía una microbiota bastante diferente. Tras realizar un tratamiento con el antibiótico rifaximina en ambos grupos, se vio que los que más mejoraron fueron los pacientes del segundo grupo (los que aparentemente presentaban una «disbiosis»).
INTESTINO GRUESO Y PH
Otro factor que puede influir sobre las alteraciones de la microbiota en el SII es el PH (potencial de hidrógeno, que sirve como medida de la alcalinidad o acidez). Un PH más alto, más alcalino, es un entorno donde las bacterias proliferan con más facilidad, y un entorno más ácido, con un PH más bajo, es un entorno hostil para ellas. Por este motivo, la flora bacteriana suele ser mínima en el estómago (salvando quizá la Helicobacter Pylori, el Rambo de las bacterias), donde el ácido clorhídrico las mantiene a raya, y muy escasa a lo largo del intestino delgado, por donde aún encontramos ácidos gástricos, a los que se unen los biliares y pancreáticos. Pero al llegar al íleon y al intestino grueso, donde el PH es más alto, la flora bacteriana encuentra «su lugar», y comienza a medrar alimentándose de los restos orgánicos que llegan hasta aquí (almidones, fibras, FODMAPs…), y produciendo gases diversos en el proceso fermentativo (hidrógeno, metano, sulfuro de hidrógeno y dióxido de carbono), así como metabolitos que pueden interactuar con la mucosa y el sistema inmune (el isovalerato por ejemplo activa a las células enteroendocrinas, de las que hablaremos más adelante).
Pues bien, en un estudio publicado en 2015 y destacado por «Nature», se vio que los pacientes con SII tenían un PH colónico significativamente más bajo (más ácido) que el de personas sin el trastorno (6.8 frente a 7.3, una diferencia de 0.5). El impacto de esta alteración sobre la flora intestinal, o sobre los síntomas del SII, no ha sido esclarecido aún, aunque en este estudio el PH correlacionaba positivamente tanto con el tiempo de tránsito colónico como con los síntomas (que, dentro de los pacientes con SII, eran peores con un PH más alto, indicativo de una mayor proliferación de bacterias). Un estudio previo, de 2014, pareció encontrar resultados similares, encontrando también un PH significativamente más bajo (más ácido) en pacientes con SII, en los que no obstante seguía habiendo una correlación positiva del PH colónico con síntomas como hinchazón y distensión.
DIETA LOW FODMAP Y CONTROVERSIAS
Una de las mayores evidencias del rol de la microbiota en el SII es el éxito de una dieta baja en carbohidratos fermentables (FODMAPs) para controlar los síntomas, siendo útil en cifras de entre el 50 y el 85% de pacientes (ver apartado «Dieta»).
Una dieta low FODMAP mejora los síntomas del SII en un número significativo de pacientes (no en todos), pero hay quien le atribuye efectos supuestamente negativos (2018), al reducir el número de bifidobacterias (de las más beneficiosas, a priori), reducir la abundancia total de bacterias (aunque mantiene la diversidad de las distintas cepas), reducir la cantidad de bacterias productoras de butirato como Akkermansia Muciniphila, y aumentar la cantidad de bacterias como Ruminococcus torques, que suelen abundar en los SII.
Otros estudios niegan estos supuestos “efectos negativos” de la dieta LOW FODMAP sobre la microbiota. En uno de ellos (2017), no se observa ninguna diferencia en la microbiota de pacientes con SII antes de una dieta low FODMAP y durante la misma. Es más, en otro estudio (2014) se investigó precisamente lo contrario: qué pasará en la microbiota de un paciente con SII si lo atiborramos a FODMAPs. En él, se puso a personas sanas y personas con SII en una dieta alta en FODMAPs, o sea, una dieta rica en sustratos fermentables, durante 3 días. La dieta provocó síntomas como gases y molestias abdominales en ambos grupos, peores en los SII, pero sin observarse grandes diferencias. No obstante, las personas sanas no vieron su microbiota alterada con esta dieta, mientras que la microbiota de las personas con SII se volvió inestable, con variaciones en las cepas de los phylum Bacteroidetes y Firmicutes, y se redujo la diversidad microbiana (las dietas LOW FODMAP reducen la cantidad de bacterias de cada especie, pero no suprimen especies, con lo que la diversidad se mantiene).
En la misma línea de estas investigaciones, una revisión de 2020 analizó diversos estudios sobre el efecto de la restricción o suplementación con FODMAPs en diferentes modelos animales, concluyendo que la dieta low FODMAP reducía la abundancia de Bifidobacterias, sin efectos adversos conocidos sobre la salud, y no reducía la diversidad bacteriana, mientras que una dieta alta en FODMAPS o suplementada con prebióticos (sustratos fermentables que sirven de alimento a las bacterias) aumentaba considerablemente el número de Bifidobacterias, pero podía tener efectos negativos sobre la salud intestinal, al aumentar la disfunción de la barrera mucosa colónica, la inflamación de la mucosa y la hipersensibilidad visceral. Hay que recordar que el estudio se hizo en animales, sería necesario replicarlo en personas sanas y con trastornos funcionales digestivos para verificar estos hallazgos.
Hasta el día de hoy, la creencia mayoritaria es que la dieta low FODMAP funciona en el SII porque reduce la ingesta de carbohidratos con una alta potencia osmótica como fructosa o sorbitol (que al no ser absorbidos en el ID, aumentarían el paso del agua hacia éste, provocando diarreas), o de carbohidratos muy fermentables como los fructo/ galactooligosacáridos (que podrían generar mucho gas). Es decir, que simplemente reduce alimentos que nos producen diarreas o gases/dolor a personas con una vulnerabilidad previa. Esta imagen, extraída de un artículo de Nature de 2014 y elaborada por Staudacher y cols., resume el mecanismo básico de la dieta low FODMAP.
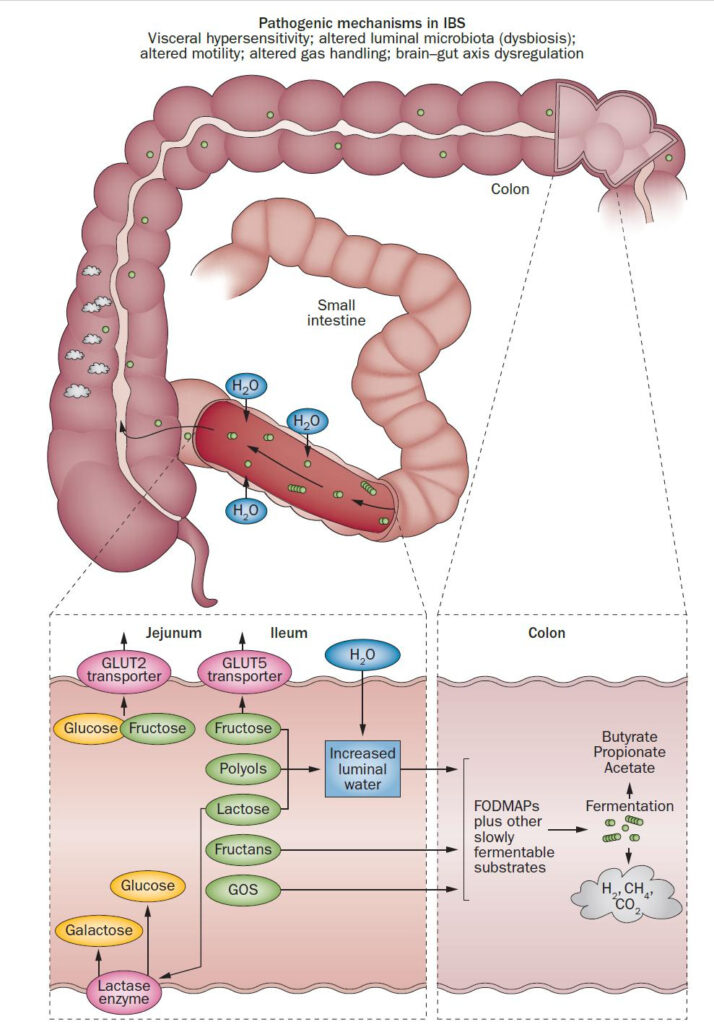
Algunos FODMAPs como la fructosa (receptores GLUT-2 y GLUT-5) o la lactosa (hidrolizada a glucosa y galactosa por la lactasa) pueden ser absorbidos, pero si no se absorben, ambos pueden, como los polioles, llevar a cambios osmóticos en el íleon (diarrea). Si los FODMAPs no absorbidos llegan hasta el colon, pueden aumentar la producción de gas luminal, cuyo tránsito está alterado en el SII, además de estimular aún más la hipersensibilidad visceral y empeorar los síntomas. Los GOs de la foto son los galactooligosacáridos, un tipo de FODMAP, y el CH4 es gas metano.
Sin embargo, algunos estudios, aún minoritarios, han sugerido que podría haber mecanismos muy diferentes en la base de la efectividad de esta dieta. En esta línea, una revisión de 2019 encontró que los pacientes con SII tenían niveles más reducidos del péptido YY (PYY, implicado en la motilidad y la sensibilidad visceral) en biopsias de colon, pero una dieta low FODMAP parecía normalizar estos niveles a la vez que mejoraba los síntomas de la mayoría de pacientes.
LA FERMENTACIÓN DE LOS FODMAPs
Hasta ahora, por lo que leímos en los apartados de intolerancias alimentarias, podríamos interpretar que los problemas de fermentación sólo ocurrían en intolerantes a la lactosa, fructosa, sorbitol…que la fermentación siempre era un sinónimo de síntomas, y que en el resto de personas no había fermentación. Pero la realidad es que, en una dieta normal, siempre hay fermentación de determinados alimentos cuando llegan al intestino grueso (y, en menor medida, en el intestino delgado).
El que la fermentación provoque síntomas o no se asocia a muchos factores, como la cantidad de carbohidratos que fermentan (si hay una malabsorción de azúcares en el intestino delgado, como puede pasar con la lactosa o fructosa, serán más). De hecho, en personas con SII, una fermentación normal, que produzca una cantidad normal de gases, puede provocar síntomas debido a la hipersensibilidad visceral y la motilidad alterada de éstos. Las fibras, por ejemplo, o los oligosacáridos fermentables (rafinosa, estaquiosa, verbascosa), no se absorben apenas en el tracto digestivo, por lo que llegan al intestino grueso casi intactos en todas las personas. Y son fermentados por las bacterias allí presentes en todos los casos. Pero sólo a ciertos pacientes esta fermentación les dará problemas.
¿Cómo consiguen los FODMAPS provocar síntomas? Por un lado, aumentan la carga osmótica, lo que facilita, por un lado, la diarrea, al aumentar la acumulación de agua en el intestino delgado (fructosa, polioles), y, por otro lado, la fermentación bacteriana de los oligosacáridos que llegan hasta el colon y de la lactosa, fructosa o polioles que los acompañen (estos últimos dependiendo de si hay intolerancias o no) produciendo gases como hidrógeno y dióxido de carbono (el caso de fructanos como la inulina o fructooligosacáridos, entre otros FODMAPs). Ambos factores provocarán una distensión luminal (el tubo digestivo se “hincha”), lo que estimula a los mecanorreceptores, que:
- Envían mensajes al cerebro que avisan de sensaciones de dolor o hinchazón
- Provocan respuestas reflejas del diafragma y de la pared abdominal anterior, aumentando la distensión, y
- Tienen efectos en la motilidad, cambiando los “hábitos” intestinales (estreñimiento, diarrea).
Como ya sabemos, los FODMAPS son carbohidratos de cadena corta (Fermentable Oligosaccharides, Disaccharides, Monosaccharides…) y polioles (…and Poliols). Los carbohidratos están formados por 3 componentes: almidón, azúcar, y fibra. Los dos primeros se sintetizan para ser utilizados como energía, y el tercero es la parte que el cuerpo no descompone y llega “intacta” al intestino grueso, donde posteriormente fermentará.
Como ya decíamos al principio de este epígrafe, las personas sanas, por lo general, tampoco tienen problemas con la fermentación de fibras, ni siquiera con la fermentación de ciertos azúcares o almidones cuando éstos, por algún motivo, llegan hasta el intestino grueso.
Entonces, ¿por qué algunas personas tienen tantos problemas al darse esta fermentación?
Un motivo es la hipersensibilidad visceral ya mencionada, de hecho, los estudios realizados hasta la fecha no permiten afirmar que los pacientes con SII tengan más gas que las personas sanas en su intestino. Sin embargo, hay evidencia científica preliminar para pensar que los procesos fermentativos de las bacterias puedan estar alterados en estos pacientes, y esto podría, de una u otra manera, repercutir sobre los síntomas. En el estudio del que partimos en este apartado (2015), se estudia la relación entre la dieta, el estado de la microbiota, y los productos de la fermentación de esa microbiota, relación en la que la barrera intestinal parece estar muy implicada.
Con barrera intestinal nos referimos a la separación entre la luz intestinal (el interior del tubo digestivo, por donde pasan los alimentos) y el resto del cuerpo, separación que viene a ser como un control de aduanas por mecanismos de transporte transcelular (a través de la célula epitelial), o paracelular (a través del espacio entre dos células epiteliales, controlado por proteínas de unión estrecha).
La barrera intestinal tiene 5 capas:
1. El lumen (luz intestinal), donde los ácidos biliares (del páncreas y vesícula) y los ácidos gástricos degradan las bacterias y antígenos.
2. Nuestras propias bacterias del lumen (les quitan alimento a las otras, cambian el PH, producen sustancias antimicrobianas que matan patógenos…)
3. Recubriendo el epitelio intestinal (los enterocitos que vimos en las fotos del apartado 2) está el microclima, consistente en una capa de moco (que contiene IgA secretora e impide la adhesión de bacterias patógenas al epitelio), agua y el glicocálix (glicoproteínas que proyectan al citoplasma apical de los enterocitos, donde están el GLUT-5 o el SLGT-1 que ya vimos).
4. El epitelio, formado por células conectadas entre ellas y que crean una barrera física y reaccionan ante estímulos nocivos con secreción de cloruro y péptidos antimicrobianos.
5. La lámina propia, con células que participan en la inmunidad innata y adquirida y segregan inmunogloblulinas y citoquinas, células del sistema nervioso entérico (intestinal) y endocrino, miofibroblastos (relacionados con la inflamación y regeneración).
Esta definición tan gratuita la hemos incluido aquí porque pronto volveremos a hablar de ella y de algunas capas, y es importante tener una idea de base. Ahora veremos los PRODUCTOS de la fermentación, para lo cual la siguiente imagen nos servirá de guía.
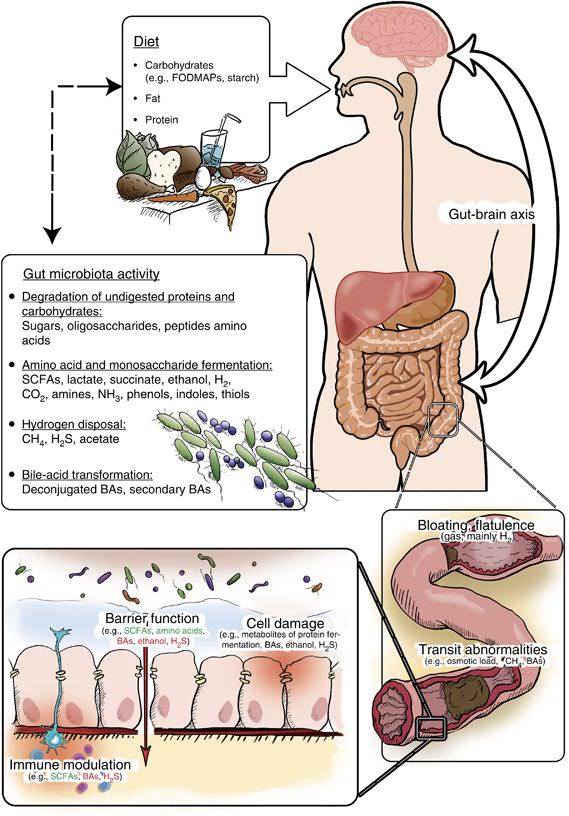
Esta foto nos describe algunos productos de la fermentación de FODMAPS que pueden afectar a diferentes áreas de la salud intestinal. Por partes:
SCFAs (Short Chain Fatty Acids o Ácidos Grasos de Cadena Corta) como el butirato mejoran la modulación del sistema inmune, mientras los BAs (ácidos biliares) y H2S (sulfuro de hidrógeno) la empeoran.
El funcionamiento de la barrera intestinal, y con él, la permeabilidad, mejora con SCFAs y aminoácidos, y empeora con ácidos biliares, etanol y sulfuro de hidrógeno. Estos últimos, unidos a metabolitos de la fermentación de proteínas (como amoníaco, que luego veremos), producen daño celular.
Las anormalidades en el tránsito, como la diarrea, se han relacionado con la carga osmótica, el metano y los ácidos biliares. Y los gases se han asociado principalmente al hidrógeno. El proceso por el que todo esto ocurre es el siguiente:
En PERSONAS SANAS, cuando comen carbohidratos, y éstos llegan al intestino grueso, su fermentación produce Ácidos Grasos de Cadena Corta (SCFAs en adelante) como el acetato, el propionato o el butirato, y cantidades variables de hidrógeno (H2) y dióxido de carbono (CO2). Entonces aparecen varios grupos microbianos, no muy abundantes, como las arqueas, que se comen el hidrógeno produciendo en su lugar más acetato, sulfuro de hidrógeno (que bloquea el metabolismo epitelial y activa las neuronas entéricas, pudiendo empeorar la hipersensibilidad visceral), o metano. Cuando estas personas comen proteínas, la fermentación de sus residuos (la proteína en sí es absorbida en el intestino delgado, al igual que los carbohidratos) tiene lugar en el colon distal (más cerca del recto que del íleon, el final del intestino delgado), produciéndose metabolitos como amoníaco, ácidos orgánicos, amidas heterocíclicas y compuestos fenólicos e indólicos, los cuales son, a priori, perjudiciales para la salud intestinal. Por otro lado, las proteínas y grasas que han sido digeridas en el intestino delgado, aumentan la producción de ácidos biliares, los cuales pueden inhibir la actividad de diversas bacterias (ver el primer nivel de la barrera intestinal antes descrito), afectando a la microbiota y a factores como la secreción, la función inmune o la motilidad (en la malabsorción de sales biliares, la bilis irrita el epitelio del colon provocando diarreas, para lo cual se recetan “secuestradores” de la bilis como la resincolestiramina). En los casos de SII surgidos a raíz una gastroenteritis infecciosa (SII-postinfeccioso), se ven correlaciones entre sus marcadores microbianos y el metabolismo de los aminoácidos.
Cuando estas personas sanas comen FODMAPs, que son carbohidratos más fermentables, y que suelen llegar en más cantidad al intestino grueso (sobre todo cuando existe alguna intolerancia y no se absorben del todo), éstos son fermentados por las bacterias colónicas, pero esta vez se produce una mayor cantidad de gas, y un efecto osmótico que puede provocar síntomas de SII en personas más sensibles, y pasar desapercibidos en personas menos sensibles. El exceso de gas producido en la fermentación de FODMAPS parece ser común a todas las personas. ¿Qué ocurre entonces en las personas con SII? Parece que éstos tienen una mayor cantidad de bacterias de la cepa Dorea, que, hasta donde sabemos, es la mayor productora de gas del intestino humano (2011, 2011). Esta podría llevar a una sobreproducción de gas, aunque la hipótesis no ha sido probada, como mucho sabemos que el gas podría acumularse y quedarse retenido formando «bolsas». Uno de los microbios que podría comerse este exceso de gas es la arquea, que absorbe 4 átomos de hidrógeno para excretar 1 de metano. Los pacientes con intestino irritable, cuando tienen predominio del estreñimiento, tienen más arqueas de lo normal y más metano en los test de aire espirado, y cuando tienen predominio de las diarreas, tienen menos arqueas de lo normal, y menos metano (2014, 2019).
Por otra parte, hablamos antes de los SCFAs, otro producto de la fermentación de los FODMAPs. Éstos tienen numerosos beneficios en personas sanas, en especial el butirato, que tiene propiedades anticancerígenas (2018), aporta energía a las células epiteliales del colon, reduce la inflamación (provoca la conversión de linfocitos T en linfocitos T “reguladores”) y refuerza la barrera intestinal (2008). Su administración intraluminal en el colon distal (2009) disminuye la sensibilidad visceral cuando no hay intolerancias/SII, es decir, en personas sanas. En cualquier caso, no hay prácticamente ninguna evidencia científica seria que respalde el uso de suplementos de butirato en pacientes con SII, a pesar de que es frecuente verlos en farmacias donde se venden con esta indicación.
METABOLITOS Y SII
Los metabolitos son moléculas utilizadas o producidas durante el metabolismo. Si hablamos de metabolitos fecales, frecuentemente (no siempre) son productos/residuos generados por las bacterias durante su fermentación. Sabemos que pueden comunicarse con el sistema nervioso entérico, con las células enteroendocrinas o con el sistema inmune (2005, 2008).
Algunos metabolitos presentes en el lumen intestinal, como los aminoácidos, han mostrado en modelos animales ser capaces de preservar la integridad de células epiteliales (previniendo la autofagia entre otras cosas), reforzar la barrera intestinal (regula la expresión de proteínas de unión estrecha), y proteger contra la inflamación y el estrés oxidativo (2013, 2015, 2015, 2016, 2017). Sin embargo, su rol en el SII no está claro.
Otros metabolitos, como los SCFAs, se han vinculado con la patofisiología del SII. Un estudio de 2010 vinculó niveles elevados de ácido acético y propiónico con los síntomas abdominales, la baja calidad de vida y las emociones negativas de pacientes con SII (aunque podrían ser sólo marcadores, la relación no era causal).
Otro estudio, de 2017, planteó que metabolitos inespecíficos del lumen intestinal, como los SCFAs isovalerato o isobutirato, pueden estimular a las células enterocromafines (EC) a través del receptor olfatorio (Olfr558), y éstas en respuesta pueden provocar hipersensibilidad visceral mediante su modulación de las neuronas sensoriales. En el dibujo extraído del estudio de Bellono y cols. (2017) se aprecia mejor:
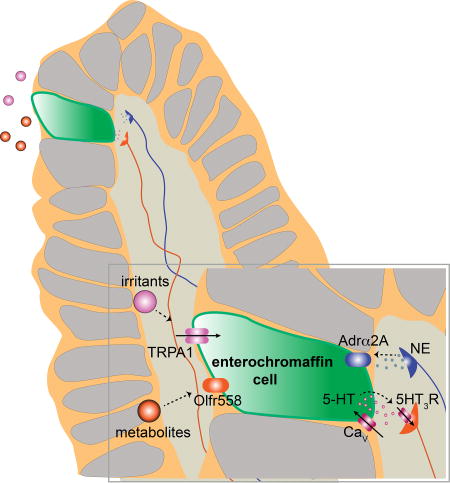
La imagen representa una de las maneras por las que los metabolitos podrían afectar a la señalización serotoninérgica y noradrenérgica, ambas implicadas en la transmisión del dolor y en la regulación de las secreciones y la motilidad.
Un estudio de 2019 analizó las alteraciones de distintos metabolitos fecales en pacientes SII-D. Encontraron que la gravedad de los síntomas (medida con cuestionario) correlacionaba negativamente con los niveles del aminoácido valina y el ácido orgánico (en teoría, producidos por la microbiota) fumarato, y positivamente con los niveles del aminoácido tirosina y los ácidos orgánicos hexanoato y piruvato. También encontraron que la hipersensibilidad visceral y el dolor abdominal (medidos con manometría anorrectal) correlacionaban positivamente con los niveles de los SCFAs isovalerato y valerato o del ácido orgánico isohexanoato. Los autores concluyeron que la alteración del perfil de los metabolitos fecales podría influir sobre el aumento de sensibilidad visceral propio de los pacientes SII-D.
EJE MICROBIOTA-INTESTINO-CEREBRO
El eje microbiota-intestino-cerebro es un modelo explicativo del SII y los trastornos funcionales digestivos que parece bastante prometedor. Si bien su existencia ya quedó demostrada en otras patologías hace bastantes años (como la encefalopatía hepática, que se origina en la microbiota), ahora es cuando se está investigando cómo se manifiesta en el SII. Este esquema, publicado por Quigley, expresidente de la American Gastroenterological Association (2018), puede ayudarnos a orientarnos:
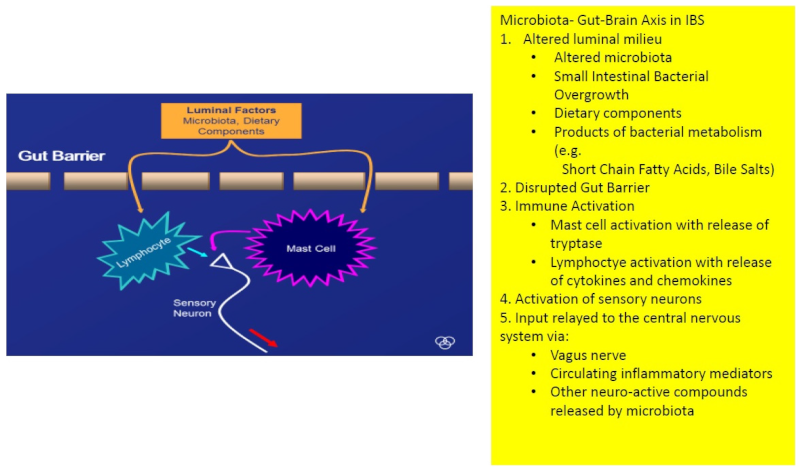
La lógica inherente a este esquema es que las bacterias, directamente o a través de sus productos (por ejemplo, un déficit de butirato), alteran la permeabilidad intestinal, lo que nos lleva a la entrada en las células epiteliales de ciertas toxinas y agentes patógenos, que desencadenan una leve reacción inmunitaria por los mastocitos (que liberan triptasa, entre otros mediadores) y linfocitos (que liberan citocinas y quimiocinas), activando a las neuronas sensoriales que median la percepción del dolor, entre otras cosas, y que se conectan con el SNC a través de varios canales, como el nervio vago, mediadores inflamatorios, u otros compuestos neuroactivos liberados por la microbiota. Todo esto es simplemente una teoría, y es muy probable que no sea un hecho generalizado (sabemos que en muchos SII no hay alteraciones en la permeabilidad, algo que este esquema no explicaría). Pero es una de las posibles maneras en que la interrelación microbiota-intestino-cerebro puede darse.
De hecho, se han encontrado varias vías (2018) por las que la microbiota y el cerebro podrían comunicarse:
- A nivel neural, por el nervio vago y la médula espinal
- A nivel endocrino, por el eje hipotalámico-pituitario-adrenal
- A nivel inmunitario, por las citoquinas
- A nivel metabólico, por los ácidos grasos de cadena corta (SCFAs), el triptófano…
Las bacterias intervienen en la liberación de sustancias como GABA (ácido gamma-aminobutírico, el neurotransmisor inhibidor por excelencia del SNC), serotonina, dopamina y acetilcolina, que actúan a nivel local en el sistema nervioso entérico, pero que a veces alcanzan el cerebro a través de canales como el nervio vago o a través del torrente sanguíneo o los órganos circunventriculares. Del mismo modo, un artículo de 2019 resumió las principales interacciones entre los SCFAs y el cerebro, a través de 4 canales muy similares a los descritos (humorales, endocrinos, inmunes y neurales), y que se producen por interacciones con receptores metabotrópicos acoplados a proteínas G y con enzimas histona deacetilasas (implicadas en la regulación de la expresión genética).
En el caso del nervio vago, éste no alcanza a estar en contacto directo con la microbiota (2007), pues nunca llega a atravesar la capa epitelial y contactar con el lumen (interior del tubo digestivo, donde están los alimentos y bacterias), aunque sí llega a las capas inmediatamente anteriores (plexos submucoso y mientérico), desde las que recibirá las “señales” de las bacterias. Hay varios mecanismos por los que esta relación puede ocurrir. Uno de ellos empieza por las células enteroendocrinas (células endocrinas situadas en el estómago y en el epitelio intestinal, constituyendo un 1% de este último en personas sanas). La interacción entre estas células enteroendocrinas (CEE, o EEC en inglés) y las aferencias del nervio vago (que sigue siendo la conexión principal entre intestino y cerebro) es clave para el funcionamiento del eje microbiota-intestino-cerebro.
Las EEC reciben señales del paso de carbohidratos, triglicéridos (grasas) y proteínas por el estómago y el lumen intestinal (2017), y modulan funciones como la motilidad, la secreción, y la ingesta de alimentos, para lo que interactúan con las aferencias del nervio vago mediante la liberación de serotonina (5-hidroxitriptamina o 5-HT), que activa los receptores 5-HT3 de las fibras vagales aferentes (los mismos que bloquea el ondansetrón para detener las náuseas y la diarrea), o mediante la liberación de hormonas intestinales como la colecistoquinina (CCK), el “péptido similar al glucagón tipo 1 (GLP-1)”, o el péptido YY (PYY), que viajan por las eferencias vagales hasta el cerebro, donde activan receptores específicos.
En un estudio de la revista Cell, en 2017, se encontró que las EEC se activaban específicamente en respuesta a:
- Metabolitos de la microbiota (como el isovalerato, asociado a trastornos gastrointestinales)
- Ciertos irritantes (el principal, el isotiocianato de alilo, típico de la mostaza)
- Catecolaminas (noradrenalina/norepinefrina, epinefrina y dopamina, todas implicadas en el estrés intestinal)
Todos los cuales podrían modificar la sensibilidad visceral, pues en respuesta a ellos, las EEC estimulan después a las neuronas sensoriales.
En esta imagen, extraída del artículo previo de 2018 en «Frontiers in Neuroscience», tenemos un pequeño resumen de las posibles interacciones en el eje microbiota-intestino-cerebro:
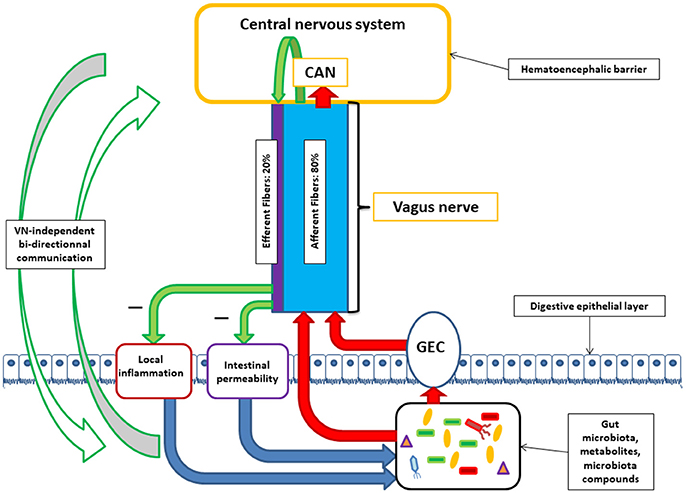
Como vemos en la imagen, el nervio vago puede ser estimulado por las bacterias intestinales (flechas rojas) de manera directa, o indirecta a través de las células enteroendocrinas (GEC o Gut Endocrine Cells), que en el colon se sitúan junto a los colonocitos (células epiteliales) y reaccionan ante determinados metabolitos que las bacterias producen al alimentarse (lipopolisacáridos o ácidos grasos de cadena corta/SCFAs), modulando la sensibilidad visceral. Luego las fibras aferentes (que llegan a…) del nervio vago estimulan el SNC por la red neuronal autonómica central (CAN), y también estimulan a las fibras eferentes (que salen hacia…) a través del reflejo inflamatorio. Las fibras eferentes del nervio vago tienen una acción antiinflamatoria, y también reducen la permeabilidad intestinal paracelular mediante el refuerzo de las uniones estrechas entre células epiteliales. Ambas acciones pueden tener efectos indirectos sobre la microbiota, modulando su composición. Además de todos estos mecanismos, parece que el eje microbiota-intestino-cerebro también dispone de varios canales que permiten una comunicación bidireccional sin tener que pasar por el nervio vago.
El eje microbiota-intestino-cerebro, como ya hemos dicho, funciona de manera bidireccional. Esto significa que, además de las variables neurológicas, las variables psicosociales también pueden tener un rol modulador sobre la microbiota intestinal. En una revisión de 2016 se concluyó que los estresores psicosociales y físicos en las primeras etapas de la vida, incluyendo la acumulación de procedimientos dolorosos (por ejemplo, en Unidades Neonatales de Cuidados Intensivos) y la separación materna, pueden alterar las funciones gastrointestinales y la microbiota, lo cual tendría un impacto importante en la salud en etapas posteriores de la vida. También se mostró que las intervenciones tempranas, como un contacto estrecho del hijo con los padres, o un entrenamiento en el manejo del estrés y el dolor, pueden voltear la balanza y permitir un desarrollo normal de estas funciones. Finalmente, en una revisión de 2018 sobre la literatura científica de los últimos 10 años, se encontró nuevamente una fuerte influencia del estrés temprano sobre el desarrollo de la microbiota, haciéndonos potencialmente más predispuestos a presentar ciertas enfermedades.
CONCLUSIONES
En definitiva, el debate no puede estar más abierto, pero parece haber algunos consensos:
- A día de hoy, resulta imposible definir con precisión lo que sería una “mala” flora intestinal. El concepto de «disbiosis» no está del todo claro, aunque se cree que una alta diversidad (que no abundancia) de distintas cepas es algo positivo.
- El haber nacido por cesárea, no haber tenido una lactancia del pecho de la madre y haber crecido en un entorno excesivamente limpio, son todos factores de riesgo para desarrollar problemas digestivos como el SII y otras enfermedades autoinmunes y metabólicas, como celiaquía, diabetes tipo 1, asma y obesidad.
- Las personas con SII parecen presentar una mayor cantidad de bacterias de la cepa Dorea, la mayor productora de gas del intestino humano conocida hasta la fecha. Y también parece haber un exceso (cuando predomina el estreñimiento) o un defecto (cuando predominan las diarreas) de arqueas, microorganismos procariotas que se alimentan del gas hidrógeno.
- Si ponemos a un paciente con intestino irritable en una dieta alta en FODMAPs durante un periodo de varios días, sus síntomas empeoran y la diversidad de su flora intestinal podría reducirse.
- Hay evidencia suficiente para considerar que las bacterias interactúan con el cerebro, y que podría existir un eje microbiota-intestino-cerebro en el que se enmarcan los trastornos funcionales digestivos. Los canales por los que esta comunicación tiene lugar pueden ser neurales, endocrinos, inmunitarios y metabólicos, y hay varias estructuras específicas implicadas, como el nervio vago, el torrente sanguíneo o los órganos circunventriculares. Una estructura implicada en la conexión bacterias → cerebro, cuyo rol se está empezando a comprender, son las células enteroendocrinas.
