Alteraciones endocrinas
En este apartado hablaremos de algunas alteraciones endocrinas habituales en pacientes con SII. Trataremos temas como las hormonas femeninas, el ciclo menstrual, los ritmos circadianos y hábitos de sueño, o las células enteroendocrinas. Una de las alteraciones más investigadas, las del eje hipotálamo-hipofisario/pituitario-adrenal (HHA/HPA) será tratada en otro apartado, al haberse investigado históricamente de la mano de las alteraciones psicosociales, con las que mantiene una relación bidireccional.
HORMONAS FEMENINAS Y CICLO MENSTRUAL
Un estudio de 2018 descubrió que las alteraciones en el cromosoma 9q31.2 (en una región anteriormente relacionada con la edad de la primera menstruación) predicen el riesgo de desarrollar SII, especialmente SII-E, pero sólo en mujeres. Este hallazgo podría ser una pista para la mayor prevalencia de este síndrome en el sexo femenino. Por otro lado, un estudio prospectivo de 10 años con mujeres islandesas (2012) encontró que un diagnóstico de SII aumentaba significativamente el riesgo de desarrollar dismenorrea (menstruaciones dolorosas) más adelante.
Es evidente que ambos problemas están muy vinculados para un subgrupo de pacientes. De hecho, es bastante común que los síntomas del SII empeoren durante la menstruación (Monash University, 2017).
Los niveles de hormonas sexuales femeninas (estrógeno y progesterona) fluctúan durante todo el mes.
El estrógeno alcanza su pico justo antes de la ovulación (en torno al día 14 del ciclo menstrual, acabando la «fase folicular»), seguido de una rápida caída después de ésta.
La progesterona alcanza su pico durante la «fase lútea» (que empieza inmediatamente después de la ovulación y dura unos 14 días de media, hasta que empieza la menstruación, y con ella, la fase folicular), y los niveles caen rápidamente justo antes del comienzo de la menstruación.
Ambas hormonas están en su nivel más bajo al comienzo del período (día 1 del ciclo menstrual), y los estudios han señalado que los síntomas del SII tienden a empeorar a medida que disminuyen los niveles hormonales. Esto podría deberse a que, al igual que el útero, el intestino también tiene receptores para estas hormonas, que pueden afectar a la forma en que el intestino se contrae, la sensibilidad intestinal y los niveles de inflamación (2015).
El estrógeno tiene 3 tipos de receptores, alfa (ERα) y beta (ERβ), que se expresan en el núcleo de la célula, y los receptores de estrógenos asociados a proteínas G (GPER), que se expresan en la membrana celular (2020). Un estudio de 2018 encontró que la expresión de ERα (en mujeres menores de 50) y GPER (en hombres) estaba aumentada en pacientes con SII-D, correlacionando con alteraciones simultáneas en el número de citocinas inmunomoduladoras y sugiriendo un rol del estrógeno en la desregulación de la respuesta inmune local observada los pacientes (alteraciones en la expresión de las citocinas IL-6, IL-10, TNF-α y de microRNAs como miR-145, miR-148-5p y miR-592, que regulan genes implicados en la respuesta inmune). Otro estudio (2014) encontró que la expresión (total y relativa) de GPER en mastocitos del colon de pacientes SII-D era significativamente mayor a la de los SII-E y pacientes sanos, sugiriendo una relación con los síntomas diarreicos. También hallaron una correlación positiva entre el número de células del colon que expresaban GPER y la severidad del dolor abdominal en los SII-D.
El rol del estrógeno en la motilidad «normal» quedó un poco más esclarecido en un estudio de 2017, in vitro, que utilizó tejido colónico sano extraído de personas a las que les habían practicado una resección tumoral espontáneamente durante una exploración para sacar biopsias (no eran pacientes de SII). Se comprobó que al cultivar este tejido con agonistas de GPER (uno selectivo, es decir, específico de ese receptor, y otro no selectivo), la contractilidad muscular del mismo se reducía significativamente.
Un dato que podría ser relevante es que el estrógeno activa los mastocitos a través del receptor IgE (2007), receptor que también regula las alergias alimentarias. Ya vimos que los mastocitos podrían jugar un importante papel en la sintomatología del paciente con SII, y esto podría ser relevante considerando que las mujeres tienen mayores niveles de estrógenos, y una mayor ratio de casos de SII. En otras investigaciones se ha demostrado un rol modulador del estrógeno en el dolor visceral (2019) a nivel periférico, espinal y supraespinal, aunque los hallazgos todavía son contradictorios.
METABOLISMO DE LA MELATONINA Y RITMOS CIRCADIANOS
La melatonina es una hormona producida principalmente en la glándula pineal, que participa en mecanismos fisiológicos diversos del cuerpo humano, siendo el principal el control de los ritmos circadianos, o lo que es lo mismo: el ciclo diario del sueño. Nuestro ritmo circadiano tiene un efecto significativo en la salud intestinal, al afectar a la motilidad intestinal, la secreción de jugos gástricos, el mantenimiento y restauración de la mucosa protectora de la barrera intestinal, la producción de enzimas digestivas, el transporte de nutrientes en el intestino delgado, y el sistema inmune del tracto gastrointestinal (ver estudio de 2011).
La melatonina se metaboliza en el hígado y sus metabolitos (partículas generadas en este metabolismo) se excretan por la orina. En estudios realizados en pacientes de SII se ha demostrado que ciertos metabolitos de la melatonina están alterados en pacientes con SII, al compararlos con controles sanos. En un estudio de 2009 se observó que el metabolito 6-sulfatoximelatonina era significativamente menor en pacientes con SII-E o SII-D que en controles sanos, y también, dentro de los que tenían SII-E, era significativamente menor en hombres que en mujeres. En otro estudio de 2010, en mujeres con SII pre y postmenopáusicas, se observó que los niveles de 6-sulfatoximelatonina, tanto en mujeres premenopáusicas como postmenopáusicas, eran significativamente más elevados en los grupos de SII-D o SII-E que en controles, aunque se veía un descenso (no significativo) del metabolito en el grupo de SII-E postmenopáusicas. Sin embargo, al valorar la gravedad de los síntomas de cada caso particular, se vio que los niveles de 6-sulfatoximelatonina sólo correlacionaban con la gravedad en las pacientes con SII-D.
También se ha sugerido que el tener un ritmo circadiano cambiante, con horarios de sueño inestables, puede ser un factor de riesgo que precipite la aparición de un SII. Ya en 2010 se hizo un estudio con 399 enfermeras que trabajaban en distintos turnos (diurno, nocturno, rotación), para ver si un horario cambiante se relacionaba con una mayor prevalencia de trastornos funcionales digestivos, principalmente SII. Los resultados fueron demoledores, observándose una incidencia significativamente mayor de SII y dolor abdominal en las enfermeras que tenían turnos de rotación (otros trastornos funcionales digestivos que cursan sin dolor, como la diarrea o estreñimiento funcionales, eran igual de frecuentes en todos los grupos). La incidencia de SII y dolor abdominal era independiente de la calidad del sueño, es decir, que el dormir mejor o peor no tenía relación con la aparición del trastorno, pero el dormir a horas cambiantes sí la tenía. De este modo, los autores concluyeron que las alteraciones del ritmo circadiano podrían tener un rol en la patogénesis de ciertos tipos de SII. Un metaanálisis de 36 estudios realizado en 2018 llegó a conclusiones parecidas, aunque señaló que es pronto para hablar de un rol causal de las alteraciones del sueño en el SII.
A la luz de estos hallazgos, se ha planteado en diversos estudios el uso de melatonina como un agente terapéutico en el SII. En un metaanálisis de 2010, que revisaba 8 ensayos clínicos, los pacientes con SII parecían mostrar alteraciones en los niveles endógenos de esta hormona, y mejoras significativas en el dolor abdominal y la sintomatología global al corregir estas alteraciones con melatonina exógena. Una revisión de 2015 se mostró un poco más crítica con el uso de melatonina, señalando en las conclusiones que no está del todo clara su utilidad o su mecanismo de acción sobre los síntomas del SII.
CÉLULAS ENTEROENDOCRINAS
Las células enteroendocrinas son células del sistema endocrino que se encuentran dispersas a lo largo del epitelio gastrointestinal , junto a las células mucosas superficiales del estómago, los enterocitos del intestino delgado y los colonocitos del colon.
Éstas células, por tanto, están en contacto directo con los contenidos del lumen, y sirven de enlace entre éstos y el sistema nervioso, con el que tienen numerosas interacciones. Por este motivo, son un pilar fundamental del eje microbiota-intestino-cerebro.
En este dibujo, extraído de un estudio de El-Salhy (2020), se puede apreciar mejor:
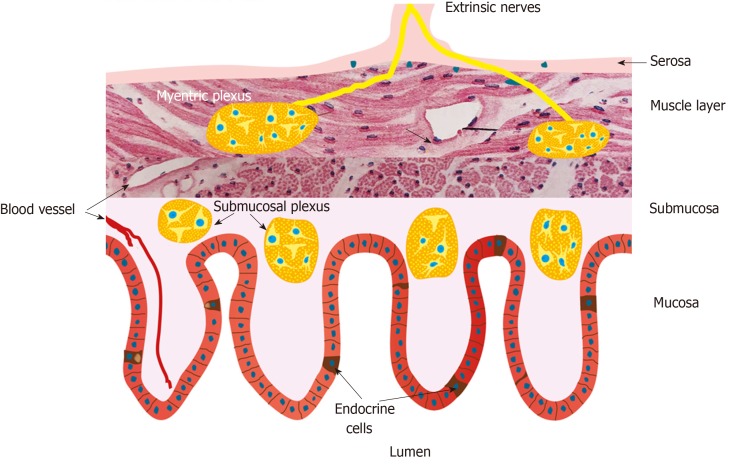
Estas células secretan diversas hormonas que interactúan con el sistema nervioso de muchas maneras. Si enumeramos algunos tipos de células enteroendocrinas presentes en nuestro intestino, tenemos (1992, 2009, 2009, 2011, 2012):
Células S: En el intestino delgado. Al entrar jugó ácido en el intestino delgado, estas células segregan la hormona secretina, la cual estimula la secreción de jugo pancreático y bilis, inhibe la secreción de jugo gástrico, promueve el crecimiento normal y el mantenimiento del páncreas, y estimula el efecto de la CCK (colecistoquinina).
Células CCK: En el intestino delgado. Cuando contactan con proteínas parcialmente digeridas (aminoácidos) , triglicéridos y ácidos grasos que ingresan al intestino delgado, segregan la hormona colecistoquinina (CCK), la cual estimula la secreción de jugo pancreático rico en enzimas digestivas, produce la liberación de bilis de la vesícula biliar y la apertura del esfínter de Oddi, e induce la saciedad (sensación de plenitud). La CCK también inhibe el vaciamiento gástrico, promueve el crecimiento normal y el mantenimiento del páncreas, y estimula el efecto de la secretina. La CCK es una hormona anorexigénica, lo que significa que reduce el apetito.
Células I: En el intestino delgado. Segregan la hormona colecistoquinina (CCK).
Células K: En el intestino delgado. Cuando detectan glucosa en el tubo digestivo (es decir, poco después de una comida), segregan el péptido insulinotrópico dependiente de glucosa (GIP), que estimula a las células beta del páncreas para que produzcan insulina.
Células N: En el intestino delgado. Liberan neurotensina, neuropéptido que regula las secreciones del intestino y las contracciones de la musculatura lisa (aspectos muy relevantes en la motilidad intestinal).
Células D: En el intestino delgado. Segregan la hormona somatostatina, que inhibe la producción de glucagón e insulina, reduce la motilidad y absorción de nutrientes y ralentiza la digestión.
Células L: En el intestino delgado y grueso. Segregan GLP-1 (péptido similar al glucagón tipo 1, es una hormona que estimula la producción de insulina dependiente de glucosa y reduce la de glucagón), GLP-2 (el tipo 2, que actúa como factor de crecimiento del tejido intestinal), PYY (péptido que actúa como una hormona anorexigénica, reduciendo el apetito, y que en algunos estudios se ha vinculado con la motilidad y la sensibilidad visceral, 2019) y oxintomodulina (hormona anorexigénica).
Células enterocromafines: En el intestino delgado y grueso, también llamadas células EC. Producen serotonina, sustancia P (péptido clave en la percepción del dolor) y a veces la hormona somatostatina (que inhibe la producción de glucagón e insulina, reduce la motilidad y absorción de nutrientes y ralentiza la digestión), entre otros mediadores. No confundir con las células similares a las enterocromafines o células ECL, que aparecen en el estómago y segregan histamina (la cual estimula el ácido clorhídrico).
En definitiva, estas células regulan aspectos como motilidad, absorción de nutrientes, sensibilidad visceral, proliferación de células intestinales, apetito… Pero lo más interesante de cara al eje microbiota-intestino-cerebro es que tienen microvellosidades que les permiten identificar los contenidos del lumen (incluyendo bacterias) como quimiosensores, y responder mediante la liberación de hormonas a la lámina propia, las cuales actúan a nivel local (señalización paracrina) o alcanzan el torrente sanguíneo y actúan en estructuras del resto del cuerpo (señalización endocrina) (2020).
En el SII, tradicionalmente se ha sugerido que el número de células enteroendocrinas en el intestino de estos pacientes podría estar alterado (2009), aunque es una idea controvertida. Un estudio de de 2020 no encontró diferencias entre pacientes SII y sujetos sanos al comparar el número de células enteroendocrinas en el yeyuno de ambos. Otros estudios, realizados en pacientes postinfecciosos de SII-D, encontraron niveles aumentados de células productoras de serotonina (EC) en el recto de éstos (2000, 2003, 2008, 2009).
Un estudio de El-Salhy (2012) sugirió que las células enteroendocrinas del duodeno de estos pacientes tenían menos densidad que las de controles sanos. Otro estudio del mismo autor, en 2017, encontró que los tratamientos dietéticos no sólo mejoraban los síntomas de estos pacientes, sino que incrementaban significativamente la densidad de las células productoras de serotonina (EC) y somatostatina (EC, D). El mismo autor ha sugerido recientemente que las células madre podrían estar en el origen de estas alteraciones (2020), pues estudios de su equipo encontraron que los pacientes SII presentaban una menor densidad de células inmunorreactivas a Musashi 1 (marcador de células madre intestinales) y neurogenina 3 (marcador de progenitores de las células enteroendocrinas derivados de células madre intestinales), tanto en el intestino delgado como en el grueso. Esto implicaría una menor actividad clonogénica de las células madre intestinales y una menor diferenciación de su progenie en células enteroendocrinas.
