Sistema nervioso entérico y SII
En este apartado vamos a indagar en algunas alteraciones neurológicas encontradas en pacientes con SII, siguiendo los puntos marcados por Maite Casado-Bedmar y Åsa V. Keita (2020), y ampliando donde lo veamos necesario. Nos centraremos principalmente en alteraciones del sistema nervioso entérico (del propio intestino), ya que en el próximo apartado queremos hablar más de los mecanismos «centrales» del SII.
Células gliales entéricas
En el sistema nervioso del intestino, o sistema nervioso entérico (SNE), podemos encontrar un conjunto de células gliales (células auxiliares que complementan a las neuronas en su labor), llamadas células gliales entéricas (EGC), a las que estudios recientes han vinculado con la regulación de la motilidad, la activación inmune y la integridad de la barrera epitelial (2006, 2007) a través de mediadores solubles. Un estudio de 2018 analizó sobrenadantes de las biopsias del colon de pacientes con SII (D, E, M) y personas sanas, que luego fueron incubados en un cultivo de células EGC de ratas. Encontraron que en todos los subgrupos de SII, las células EGC parecían tener niveles más reducidos de la proteína S100β (que se encarga, entre otras cosas, de estimular la circulación de Ca2+, o de aumentar la proliferación de axones), reducción que correlacionaba negativamente con la intensidad del dolor y la hinchazón. Además, los sobrenadantes de SII-E redujeron la proliferación de las EGC, y los de SII-D/M redujeron la respuesta Ca2+ al ATP en las EGC (respuesta que se bloqueó con pirilamina y se reprodujo utilizando un mediador proinflamatorio como la histamina). Por último, los sobrenadantes de SII redujeron la expresión (ARNm) de conexina-43, proteína implicada en la creación de «uniones gap» (comunica el citoplasma de células adyacentes permitiendo el paso de iones como el Ca2+ y otras moléculas).
El péptido intestinal vasoactivo (VIP)
Los neuropéptidos son péptidos (molécula formada por 2 ó más aminoácidos) de 3 o más aminoácidos que actúan sobre el sistema nervioso y que se pueden comportar como neurotransmisores, neuromoduladores y neurohormonas. En el caso del neuropéptido VIP, es una neurohormona polipeptídica formada por 28 aminoácidos, que se encarga de estimular la secreción de iones y agua por el intestino e inhibir la secreción ácida del estómago (2011). En el intestino podemos encontrarlo interactuando con mastocitos, linfocitos, y, sobre todo, neuronas entéricas. En personas sanas parece que el VIP, a través de los mastocitos, podrían regular (aumentar) la permeabilidad ileal en respuesta a estresores ambientales (2013), y en pacientes con SII parece que regula la permeabilidad colónica por un mecanismo similar (2017).
El rol del VIP en el SII no está del todo claro, pero sabemos que la expresión génica a nivel plasmático de este neuropéptido está triplicada en pacientes con SII (2015).
Un estudio de 2017 demostró, utilizando biopsias colónicas de pacientes SII/controles en cámaras de Ussing, microscopía electrónica, y bacterias marcadas por fluorescencia (Escherichia coli HS y Salmonella typhimurium), que en el SII el paso de bacterias comensales y patogénicas a través del epitelio intestinal era superior al normal, y tenía lugar principalmente por la ruta transcelular (a través de la célula). Lo interesante de cara a este apartado es que el proceso parecía estar mediado por el VIP y los mastocitos, pues el paso de bacterias se reducía considerablemente con el uso in vitro de un anticuerpo contra los receptores VPACs o del estabilizador de mastocitos (y antihistamínico) ketotifeno. Los niveles de VIP en el plasma sanguíneo de pacientes con SII eran superiores a los de los controles, y las biopsias de SII tenían un mayor número de mastocitos que expresaban el receptor VPAC1 en comparación a las biopsias de controles sanos.
Taquiquininas y receptores de neuroquininas
Las taquiquininas son neuropéptidos sintetizados principalmente por neuronas que regulan la motilidad intestinal, la secreción y las funciones vasculares. La familia de las taquiquininas incluye, por ejemplo, la sustancia P (SP, péptido que regula la percepción del dolor) y las neuroquininas A (implicada en el dolor y los procesos inflamatorios) y B (implicada en la producción de gonadotropina o el embarazo). La actividad biológica de las taquiquininas está mediada por los receptores de neuroquininas 1 (NK1R), NK2R y NK3R, y se sabe que los receptores de taquiquininas en las células inmunes se activan durante la inflamación intestinal.
La SP puede encontrarse en todo el tracto digestivo y sus efectos están mediados a través de los NK1R, que también están en todo el SNE y se expresan, por ejemplo, en enterocitos y células inmunes. Las neuronas que contienen SP se encuentran adyacentes a los mastocitos de la mucosa, lo que sugiere una relación entre las aferencias vagales/espinales y las células epiteliales e inmunes de la mucosa. Estudios en animales han demostrado que SR140333, un antagonista de NK1R, aliviaba la hiperalgesia visceral inducida por el estrés (2006), y el bloqueo de este receptor también inhibe la disfunción de la barrera intestinal causada por el estrés crónico en ratas (2010), donde la SP es clave en la regulación de la permeabilidad intestinal.
En contraste con SP, las neuroquininas A y B se unen a NK2R, que se expresa principalmente en la mucosa muscular y en los enterocitos y las células inmunes. Los estudios preclínicos y los ensayos clínicos han demostrado que la inhibición de NK2R puede constituir una opción novedosa en el tratamiento del SII, aunque los estudios clínicos con ibodutant, un antagonista de NK2R utilizado para la reducción de la motilidad intestinal y el dolor en mujeres con SII, han sido bastante controvertidos hasta la fecha (2019).
CRH y sus receptores
La CRH, también conocida como factor liberador de corticotropina, es una hormona endocrina producida en respuesta al estrés, activando el eje HPA (ver apartado sobre alteraciones psicosociales y eje HPA), que produce hormona adrenocorticotrópica (ACTH) y cortisol. No es un factor neurológico per se sino endocrino, pero lo hemos incluido también en esta sección por ser una parte relevante del eje intestino-cerebro.
En un estudio de 2004, la administración periférica de un antagonista no selectivo del receptor de CRH (CRH α-helicoidal) en pacientes con SII, demostró una mejora en los problemas de motilidad gastrointestinal y dolor visceral inducidos por estimulación eléctrica, sin alterar los niveles plasmáticos de ACTH y cortisol. La activación de los receptores de CRH también parece estar relacionada con la permeabilidad intestinal y la inflamación. Se ha visto que, en biopsias de colon de personas sanas, la exposición in vitro a CRH provocaba un aumento de la permeabilidad intestinal, aumento que se inhibía al bloquear los receptores CRH con la administración in vitro de CRH α-helicoidal o el estabilizador de mastocitos lodoxamida (2008). Del mismo modo, como vimos en el apartado de alteraciones inmunitarias, sabemos que los mastocitos tienen receptores específicos para CRH (los CRF-R1/CRH1R o receptores tipo 1 de CRF/CRH), pero estudios con mastocitos humanos LAD2 han mostrado que la CRH por sí sola no puede inducir la degranulación de éstos, aunque sí que puede potenciarla (2017), proceso que se asocia con un aumento de la liberación de Ca2+ de las reservas intracelulares.
Un estudio de 2017 investigó el eje HPA, la motilidad colónica y las respuestas autónomas a la administración de CRH, así como las alteraciones de la actividad cerebral en pacientes con SII. Sus resultados mostraron mayores respuestas de ACTH a la CRH en pacientes con SII, en comparación con controles sanos. Se puso a ambos grupos en una situación de distensión rectal y se observó que, en los controles, conforme más se activaba la corteza cingulada anterior pregenual del cerebro (pACC en inglés), menor era la respuesta de ACTH a la CRH, algo que no ocurría en los pacientes con SII. Se concluyó entonces que en pacientes con SII hay un deterioro en los inputs inhibitorios top-down (del cerebro al cuerpo) que provienen de la pACC, lo que se traduce en una respuesta gastrointestinal y neuroendocrina alterada a la CRH. Estos autores sugirieron que los tratamientos de acción central pueden amortiguar los síntomas físicos inducidos por el estrés en el SII.
Se ha sugerido el uso de antagonistas de los receptores de la CRH para tratar los síntomas del SII, como el pexarcefont, por el momento sin éxito (2009).
Serotonina
Solo alrededor del 5% de la serotonina del cuerpo humano, o 5-hidroxitriptamina (5-HT), se produce en el cerebro. La serotonina es producida principalmente por las células enteroendocrinas/enterocromafines de la mucosa intestinal (90%), así como por subgrupos de neuronas entéricas (5%).No obstante, esta serotonina no atraviesa la barrera hematoencefálica, por lo que actúa principalmente a nivel local, en el sistema nervioso entérico. Desde el sistema inmune, los mastocitos también pueden sintetizar y liberar serotonina (aunque a diferencia de la serotonina sináptica, ésta es proinflamatoria, 2010). Se sabe además que los mastocitos, las células dendríticas y los macrófagos/monocitos tienen receptores para la serotonina, lo que sugiere que ésta puede influir en la actividad de las células inmunes innatas (2017). La serotonina, como neurotransmisor, es liberada a la sinapsis por la neurona presináptica, y se dirige a receptores específicos en la neurona postsináptica, tras lo cual, unas estructuras proteicas específicas, los transportadores de la recaptación de serotonina (SERT), se encargan de tomar la serotonina sobrante y llevarla de vuelta a la neurona presináptica. Los ISRS como citalopram actúan precisamente en este mecanismo, impidiendo la unión de la serotonina al SERT y aumentando los niveles de serotonina en la sinapsis.
En un estudio de 2020 se encontraron niveles disminuidos de SERT en biopsias rectosigmoideas de pacientes con SII-D, que correlacionaban con mayores niveles de ansiedad, depresión y evaluación del dolor (el estudio también encontró que los niveles de colecistoquinina/CCK en estas biopsias estaban aumentados, correlacionando con las puntuaciones de dolor). Los niveles bajos de SERT sugieren que podría haber niveles de serotonina más altos de lo normal en el intestino de estos pacientes. En esta misma línea, otro estudio de 2019 utilizó biopsias rectales encontrando niveles más elevados de ácido 5-hidroxindolacético (5-HIAA, el principal metabolito de la serotonina) en pacientes con SII, aunque los niveles de 5-HT eran similares a los controles.
Otro estudio, de 2017, se centró en las diferencias de género en la señalización de la serotonina de pacientes SII-D. Se tomaron biopsias rectales y se midieron diversos parámetros:
- Proteínas S100A. Las proteínas S100 se unen al calcio (Ca2+) y están implicadas en la regulación de los niveles citoplasmáticos de éste, la transducción de señales y otros procesos intra y extracelulares. Las células inflamatorias y epiteliales expresan S100A8 y S100A9, que junto con la calprotectina juegan un papel en la patogenia de las EII. La S100A10 (también llamada p11) fomenta la expresión de canales iónicos sensibles a la acidez (ASICs), que a su vez activan y sensibilizan a los nociceptores viscerales. Además, la S100A10 interactúa y se co-localiza con receptores 5-HT1B, y su alteración se relaciona con la depresión. En la mucosas rectal de pacientes SII-D ya se ha confirmado una expresión aumentada de S100A10 (2007, 2013).
- Transportador de serotonina (5-HTT/SERT, SLC6A4). El SLC6A4 es el gen que expresa el SERT (y 5-HTT son otras siglas para referirse al SERT). El SERT se ha identificado en la superficie de la mucosa intestinal, sobre todo en células epiteliales de la cripta y neuronas mientéricas (1996, 2004). Se ha encontrado una expresión más baja de lo normal (↓ARNm) de SLC6A4 en la mucosa rectal de pacientes con SII, asociada con los síntomas de diarrea y estreñimiento (2012).
- Enzimas TPH. La TPH, o triptófano hidroxilasa, es la enzima que limita la velocidad de síntesis de la serotonina. Puede ser TPH1, expresada sobre todo en órganos periféricos y especialmente el intestino, y TPH2, expresada en el SNC y neuronas periféricas serotonérgicas. Se han encontrado niveles reducidos de TPH1 en la mucosa rectal de pacientes con SII (2012).
El estudio encontró que las mujeres con SII-D tenían niveles significativamente más elevados de S100A9 y SLC6A4 que los de varones con SII-D (¿más serotonina intestinal en varones?). Complementarianente, los niveles de S100A8 y S100A10 en mujeres SII-D correlacionaron positivamente con sus puntuaciones de diarrea.
La serotonina puede causar hinchazón, náuseas y vómitos (2003) y la actuación sobre estos receptores, y sobre los mecanismos de absorción de serotonina, podría desempeñar un papel clave en el tratamiento de los trastornos asociados a la sensibilidad visceral como el SII. Alosetrón y ramosetrón son antagonistas del receptor 5-HT3, que han mostrado mejorar el dolor abdominal, la consistencia de las heces, la motilidad gastrointestinal y la calidad de vida de pacientes con SII-D (2012, 2018, 2020), aunque en España no han sido comercializados y se utiliza en su lugar el ondansetrón. Respecto al ondansetrón, un estudio de 2019 mostró que los pacientes que necesitaban menos de 4 mg diarios tenían niveles significativamente inferiores de serotonina (en biopsias rectales) que los pacientes que necesitaban más dosis, y el aumento en el tiempo de tránsito (más horas sin ir al baño) que conseguían con el ondansetrón era significativamente superior. Aquellos que mejoraron la consistencia de las heces tenían más probabilidades de presentar el genotipo CC del polimorfismo de nucleótido único p.N163K rs6766410 del gen HTR3C (un polimorfismo de nucleótido único es una variación en la secuencia de ADN que afecta a una sola base de una secuencia del genoma, ya sea adenina/A, timina/T, citosina/C o guanina/G). Cabe destacar que este polimorfismo de nucleótido único ya se ha relacionado previamente con las náuseas inducidas por quimioterapia, que son el principal uso del ondansetrón en la actualidad.
En el otro extremo, aunque todavía no se ha evaluado su eficacia en los SII-E, la prucaloprida, un agonista del receptor 5-HT4, ha mostrado reducir la hinchazón, el esfuerzo, las molestias abdominales y las deposiciones dolorosas en pacientes con estreñimiento crónico (2008). Con respecto a fármacos que reducen la recaptación de serotonina sináptica, inicialmente se pensó que el citalopram mejoraba los síntomas del SII (2006), pero posteriormente se ha visto que no es efectivo para pacientes con SII no deprimidos (2010).
Receptores de potencial transitorio
Los receptores de potencial transitorio (TRPs) son una familia de canales iónicos que podemos encontrar en la membrana plasmática de diversas células. Son una parte fundamental del sistema sensorial, participando en la percepción de la temperatura ambiental, la regulación del tono vascular, la nocicepción y el dolor, la sensación de presión, los sabores o la visión. Hasta hoy se conocen unos 30 canales que comparten entre sí aspectos estructurales y funcionales. Generalmente son permeables a cationes como el sodio (Na+), el calcio (Ca2+) y el magnesio (Mg2+).
Como ahora veremos, varios de estos canales han sido implicados en la patofisiología del SII.
El receptor de potencial transitorio vanilloide tipo 1 (TRPV1) es un canal de iones de calor que produce dolor y que ha sido ampliamente investigado, expresándose principalmente en neuronas sensoriales somáticas y viscerales pequeñas y medianas (1999). Es ampliamente aceptado que su activación contribuye a la inflamación neuroinmune (2007), y que puede estar mediada por la capsaicina, el calor (> 42 ° C) y la acidosis (pH <6), entre otros (2007).
Un estudio de 2016 encontró una expresión génica aumentada de receptores TRPV1 en biopsias rectosigmoideas de pacientes con SII-D, así como de receptores P2Y de tipo 1 y tipo 2, correlacionando este último con el nivel de dolor abdominal. Previamente, en 2008, otro estudio también analizó biopsias rectosigmoideas de pacientes con SII y sujetos sanos, encontrando que los SII tenían un mayor número de fibras nerviosas totales (PGP9.5/UCHL1), y de fibras nerviosas con receptores TRPV1 (3.5 veces más) o sustancia P. También encontraron un número aumentado de linfocitos CD3 y mastocitos, y cuando compararon con el dolor vieron que los niveles de fibras nerviosas con TRPV1 y el número total de mastocitos correlacionaban positivamente con éste. Dos años después de este último estudio (2010), otra investigación usó un método muy similar para comparar nuevamente biopsias rectosigmoideas de pacientes con Enfermedad Inflamatoria Intestinal (EII) en remisión que pese a ello seguían con síntomas y cumplían criterios de SII (Roma II), pacientes con EII en remisión asintomáticos, y controles sanos, aunque en este caso no midieron los mastocitos. Encontraron que los EII/SII tenían 3.9 veces más fibras nerviosas con TRPV1 que los controles sanos, y 5 veces más que los EII asintomáticos, y que el número de fibras TRPV1 correlacionaban positivamente con la intensidad del dolor abdominal.
En cuanto al mecanismo que activa estos receptores, un estudio de 2016 cogió a pacientes con SII y controles sanos y obtuvo biopsias rectales de todos ellos, tomó los sobrenadantes de éstas, y los cultivó junto a neuronas nociceptivas de los ganglios del asta dorsal de ratones (DRG en inglés, estas neuronas son las que inician la señal de la sensación dolorosa al cerebro en seres humanos). Los sobrenadantes de los SII potenciaron las respuestas TRPV1 en un mecanismo mediado por el receptor de histamina de tipo 1 (HRH1), y se vio que esta potenciación de TRPV1 se podía replicar utilizando histamina o imidazol acetaldehído, y de hecho los pacientes con SII de este estudio mejoraron sus síntomas y el dolor tras un tratamiento (ECA) con el antagonista HRH1 ebastina. Un año después, otro estudio (2017), esta vez con SII-postinfecciosos (ver el apartado sobre el rol de las infecciones), volvió a poner sobrenadantes de biopsias de colon de estos pacientes, y de sujetos sanos, en neuronas DRG de ratones, y observó que, cuando se estimulaban con capsaicina, las neuronas nociceptivas con sobrenadantes de los SII se activaban mucho más (flujo de Ca2+ aumentado). Esta activación estaba mediada por los receptores TRPV1, pues al hacer un pretratamiento in vitro con un antagonista de TRPV1 (SB-366791), se bloqueaba la respuesta a la capsaicina. Al estudiar la expresión genética de TRPV1 en biopsias de los pacientes SII y compararlas con los pacientes sanos, se vio que no estaba aumentada, ambos tenían la misma cantidad de receptores, por lo que en los SII éstos debían estar sensibilizados. Incluso sin usar capsaicina, las aferencias nerviosas de las neuronas nociceptivas de ratones se activaban más con los sobrenadantes de los SII, y esta activación persistía tras retirar los sobrenadantes (que podrían haber «sensibilizado» a los receptores TRPV1 del ratón). El estudio no encontró ninguna diferencia entre sanos y enfermos al comparar citocinas y otros marcadores de inflamación, algo que va en contra de las teorías de la alteración inmunitaria y la microinflamación, y que nos deja con la duda de qué mediadores son los que sensibilizan el TRPV1. Sin embargo, en la última parte del experimento, mostraron que, si se cultivaban las neuronas DRG de ratones con pirilamina, un antagonista del receptor H1 de histamina (HRH1), o usando neuronas DRG de ratones que no tenían estos receptores (HRH1 knock-out), la respuesta a la capsaicina se normalizaba, y si las neuronas DRG de ratones o neuronas submucosas de personas sanas se cultivaban con histamina, el receptor TRPV1 se sensibilizaba y aumentaba su respuesta (Ca2+) a la capsaicina, demostrando así que la histamina es un mediador responsable de esta sensibilización.
Otro estudio (2016) indagó en la expresión de determinados microRNAs (miRNA) en pacientes con SII-D. Los microRNAs son pequeños ARNs de unos 22 nucleótidos de longitud que regulan la transcripción de determinados genes, uniéndose al ARNm e impidiendo su transducción en proteínas específicas, o directamente degradándolo. En otras palabras, los microRNAs lo que hacen es limitar la expresión genética. Este estudio demostró, empleando biopsias de colon, que la expresión de miR-199a/b, el miRNA que limita la expresión genética de los receptores TRPV1, estaba significativamente reducida, lo que correlacionaba inversamente con puntuaciones más elevadas de dolor visceral y mayor expresión de TRPV1. En una segunda parte del estudio, utilizaron modelos animales de hipersensibilidad visceral (ratas) donde replicaron los hallazgos anteriores, y observaron que la inyección intraperitoneal de precursores lenti-miR-199a redujeron la hipersensibilidad visceral mediante una reducción de la señalización de TRPV1, justificando una investigación más profunda de estos potenciales fármacos.
De cara a la intervención terapéutica sobre TRPV1, en 2007 la compañía farmacéutica británica GlaxoSmithKline finalizó la fase II de un ECA para probar la eficacia del antagonista de TRPV1 «SB-705498» en pacientes con SII. Desafortunadamente, los pacientes se retiraron y el estudio finalizó antes de tiempo sin publicar resultados (puede que tuviera efectos secundarios indeseables o provocara toxicidad).
Otros TRPs que se han relacionado con el SII son el receptor de potencial transitorio vanilloide 4 (TRPV4) y el receptor de potencial transitorio anquirina 1 (TRPA1). El mismo grupo de investigación que demostró la sensibilización de TRPV1 mediada por la histamina realizó un segundo estudio en 2019 con una metodología muy similar, viendo que las biopsias rectales de pacientes SII mostraban una reactividad aumentada (medida por el flujo de Ca2+) a agonistas TRPV4 y TRPA1, y que si las biopsias de sujetos sanos se cultivaban con histamina, se generaba un efecto similar (prevenido con el uso in vitro del antihistamínico pirilamina). Este aumento de reactividad no se debía a un aumento en el número de receptores (los niveles de ARNm no cambiaron), sino a una sensibilización de los mismos. Tanto los sobrenadantes de SII como la histamina podían provocar esta reactividad aumentada en neuronas ganglionares de modelos animales (ratas) si se cultivaban con ellas (las neuronas investigadas anteriormente no intervienen en el dolor visceral, pero éstas sí), efecto que no ocurría si se añadía simultáneamente el antihistamínico pirilamina. Del estudio se concluye que la histamina podría ser uno de los mediadores que sensibilizan los canales TRPV4 y TRPA1 en el SII (demostrado en neuronas humanas), probablemente influyendo en el aumento de sensibilidad visceral de estos pacientes (para esto último la evidencia es sólo animal).
Receptores opioides
Los receptores opioides (OR en inglés) tienen 3 subtipos principales δ (DOR, delta), κ (KOR, kappa) y µ (MOR, mu). Son receptores acoplados a proteínas G y expresados en neuronas del plexo mientérico y submucoso del SNE. Para aclarar a que nos referimos con «acoplados a proteínas G», vamos a hacer un breve inciso.
Las células se comunican emitiendo sustancias químicas o «mensajeros» que viajan hasta la célula objetivo, donde se unen a receptores que:
- Abren o cierran canales iónicos de la célula objetivo de manera directa (receptores ionotrópicos)
- Abren o cierran canales iónicos y/o cambian los procesos metabólicos de la célula objetivo, de manera indirecta a través de un segundo mensajero (receptores metabotrópicos)
La proteína G participa en el segundo mecanismo, que se explica en este vídeo:
De hecho, la gran mayoría de principios activos de los fármacos actuales, exceptuando algunos como los antibióticos, suelen estar dirigidos a mecanismos regulados por proteínas G. En este otro vídeo se toca el tema con un poco más de profundidad.
Acabado este inciso, los receptores opioides tienen funciones como la modulación de la motilidad gastrointestinal, la secreción y la sensibilidad visceral. Las dos primeras ayudan a pacientes con motilidad acelerada y son cualidades a las que no se desarrolla tolerancia (por eso la loperamida no es adictiva), la tercera ayuda a pacientes con dolor pero es una cualidad a la que sí se desarrolla tolerancia (2017). Como ya hemos dicho, los OR en el tracto gastrointestinal se expresan en neuronas entéricas, pero también en células intersticiales de Cajal y en células del sistema inmune (mayormente linfocitos/células T), teniendo un rol complejo en la modulación de este último (2016).
El dolor y la inflamación están íntimamente conectados, y en el apartado sobre receptores TRPV1 ya vimos cómo su desensibilización es uno de los mecanismos que explican el dolor en este trastorno. Un estudio de 2019, con animales (ratones), demostró cómo la inflamación puede activar receptores TRPV1, que generan dolor y activan a su vez un mecanismo endógeno de regulación de ese dolor, en el que la β-arrestina2, una proteína que desensibiliza receptores acoplados a proteínas G, es translocada al núcleo de la célula en lugar de unirse a receptores opioides mu (MOR). De esta manera, los receptores opioides no son desensibilizados y siguen respondiendo a los agonistas MOR, y reduciendo así la sensación de dolor. El experimento concluyó que este eje TRPV1 – β-arrestina2 podría estar en la base del control opioide periférico del dolor inflamatorio, y que la desregulación del mismo podría propiciar la transición del dolor agudo a dolor crónico.
En pacientes con SII, un experimento de 2019 utilizó biopsias del colon descendente y encontró un aumento de la expresión de MOR en células T CD4+/CD31+ y eosinófilos, pero no en mastocitos, al comparar con controles sanos (también encontraron niveles altos de beta-endorfinas y receptores cannabinoides tipo 2). Curiosamente, se ha demostrado en animales (ratones) que el bloqueo de la expresión de MOR y DOR en la membrana celular de las células T CD8 + inhibe su proliferación (2018) y en humanos que las células T CD4+ ayudan en la regulación endógena del dolor visceral y la inflamación con la producción de la citocina antiinflamatoria IL-4 (2013).
Los agonistas opioides se han planteado como un posible tratamiento del SII-D, donde funcionan reduciendo la motilidad colónica y generando estreñimiento (2013). Se han descrito con esta indicación (2017) opioides intestinales como la loperamida, un agonista de los receptores mu (MOR) ampliamente conocida y comercializada, la eluxadolina, un agonista MOR y antagonista de los receptores delta (DOR), de comercialización posterior, y la asimadolina, que pese a tener resultados prometedores en ensayos clínicos no ha sido comercializada (2008). En cuanto al uso de opioides para el tratamiento del dolor visceral del SII, tienen el inconveniente de producir tolerancia e hiperalgesia paradójica (un trastorno funcional digestivo del que hablamos en el apartado «Dolor abdominal mediado centralmente») (2017).
Neuropéptido Y & Péptido YY
Por sus siglas, NPY y PYY, son péptidos biológicamente activos, lo que viene a significar que tienen funciones propias, no se limitan a ser fragmentos de proteínas (ya hemos visto antes cómo péptidos como la sustancia P también son biológicamente activos, en su caso mediando el dolor). El NPY es de los neuropéptidos más abundantes en el cerebro, y en el intestino puede ser sintetizado por células enteroendocrinas, monocitos, macrófagos, linfocitos y células dendríticas. Por su parte, el PYY aparece casi exclusivamente en el tracto digestivo, siendo producido por células enteroendocrinas de tipo L. Ambos péptidos actúan uniéndose a 5 receptores Y, siendo Y1 e Y2 los más comunes en las células inmunitarias que pueblan el eje intestino-cerebro (2013). Los dos influyen en la función gastrointestinal motriz y secretora, la estimulación de Y1 acelera el tránsito colónico, y la estimulación de Y2 lo inhibe (2011). NPY y PYY, además de actuar en la sensibilidad visceral, pueden influir sobre el sistema inmune y actuar como moduladores pleiotrópicos.
*Inciso: La pleiotropía es el mecanismo por el que un único gen puede tener efectos fenotípicos (resultado de la expresión de ese gen) múltiples, influenciando por ejemplo el color de la piel y el sistema visual al mismo tiempo. Cuando se habla de un fármaco (o en este caso péptidos endógenos) como un «modulador pleiotrópico» puede referirse a que un mismo mecanismo tiene efectos terapéuticos múltiples.
Cada vez más estudios demuestran que NPY promueve la inflamación en el tracto digestivo (2012), y en animales (ratones) se ha visto que el bloqueo del receptor Y1 reduce la producción en los macrófagos de las citocinas proinflamatorias TNF e IL-12, así como el número de linfocitos/células T (2005).
Finalmente, entrando específicamente en el SII, algunos estudios han encontrado anormalidades en los niveles de estos péptidos en los pacientes. Un estudio de 2017 encontró niveles elevados de NPY en la sangre de estos pacientes frente a controles sanos, y otro de 2003 encontró niveles más reducidos de PYY en biopsias de colon descendente de los SII. Revisiones posteriores (2019) añaden que la concentración de PYY y su densidad celular se ven reducidas en el colon y recto de pacientes con SII, pero no en el íleon, y que esta alteración podría explicar parte de la dismotilidad y las alteraciones de la sensibilidad visceral. Además, concluyen con el hallazgo de que una dieta low FODMAP parece restaurar la densidad de las células PYY en el colon de pacientes con SII.
Neurotrofinas
Partiendo de una revisión de Chu, Liu y Yao (2016), las neurotrofinas son proteínas que actúan como «factores tróficos» (colaboran en la comunicación intercelular) y regulan el crecimiento, función, plasticidad, supervivencia y apoptosis (muerte celular) de las neuronas (2014). Algunas neurotrofinas son el factor de crecimiento nervioso (NGF), el factor neurotrófico derivado del cerebro (BDNF), o las neutrofinas 3 y 4 (NT-3 y NT-4). Son secretadas por tejidos nerviosos, astrocitos (células gliales), mastocitos y células epiteliales, y penetran en las terminaciones nerviosas a través de determinados receptores, para luego ser transportadas al cuerpo celular (soma) de las neuronas, donde regulan la síntesis de proteínas.
Estudios recientes han mostrado que el tracto gastrointestinal tiene bastantes neurotrofinas y receptores de éstas, teniendo un rol en la sensibilidad, motilidad y secreción digestivas. El NGF, la primera neurotrofina conocida, es una proteína con varias subunidades (multimérica), a saber, α, β (subunidad activa), γ. Se distribuye por diversos órganos como los ganglios, el cerebro, el músculo esquelético, el intestino, la vesícula… NGF actúa a través de receptores TrkA (alta afinidad) y p75NTR (baja afinidad), promoviendo la diferenciación neuronal, estimulando el crecimiento de dendritas y somas neuronales, y afectando a la densidad de las fibras nerviosas, y, fuera del sistema nervioso, regulando la activación, proliferación y apoptosis de mastocitos, linfocitos y células epiteliales. En circunstancias negativas como estrés agudo/crónico, daño tisular, o inflamación (entre otros), el NGF puede modificar la plasticidad de las fibras nerviosas locales, provocando hiperalgesia (dolor) y disfunción del órgano en cuestión. En la revisión de Chu, Liu y Yao (2016) que estamos siguiendo, se mencionan varios estudios que vinculan al SII con el NGF. En 2012 un estudio comprobó que las biopsias rectales de niños con SII-D tenían mayor cantidad de NGF que las de controles sanos, y este aumento correlacionaba con el número de mastocitos. Otro estudio, de 2015, encontró en pacientes con SII una mayor densidad de las fibras nerviosas, más ramificaciones neuronales, y unos niveles más elevados de NGF y TrkA en la mucosa; asimismo, observaron que los anticuerpos de NGF inhibían la neuritogénesis (↑ del número de proyecciones que salen del soma neuronal, como dendritas o axones) provocada por sobrenadantes de biopsias de los SII. Los niveles de NGF parecen mediar el dolor inflamatorio modificando la plasticidad neuronal, de hecho, los pacientes con enfermedad inflamatoria intestinal (EII) tienen mayores niveles de NGF y TrkA (2000), y el nivel de NGF parece correlacionar con la severidad de la colitis ulcerosa (2014).
Otra conocida neurotrofina es el BDNF, proteína que se une y activa al receptor de tirosina quinasa (TrkB), y que tiene una función importante en la plasticidad neuronal y el desarrollo del sistema nervioso. Un estudio de 2012 analizó biopsias rectosigmoideas de pacientes con SII, encontrando un aumento significativo en los niveles de BDNF, así como en el número total de fibras nerviosas. La microscopía electrónica mostró daños ultraestructurales en las fibras nerviosas de la mucosa (mitocondrias y axones hinchados), y el aumento en la liberación de BDNF de estas neuronas correlacionaba con las puntuaciones de dolor abdominal. Otro estudio, de 2019, encontró niveles aumentados de BDNF en fibras nerviosas de biopsias rectosigmoideas de pacientes SII-D, así como una mayor densidad de estas fibras nerviosas. El aumento en BDNF correlacionaba positivamente con el dolor abdominal y la severidad del cuadro, y negativamente con los umbrales de sensibilidad visceral medidos con manometría anorrectal (a más BDNF, menor umbral de sensación defecatoria, menor umbral máximo de distensión luminal tolerada, y menor umbral del reflejo inhibitorio rectoanal).
Sistema endocannabinoide
El sistema endocannabinoide está formado por una serie de receptores cannabinoides a lo largo del Sistema Nervioso Central y el Sistema Nervioso Periférico, a los que se unen una serie de lípidos neuromoduladores para controlar funciones como el apetito, el ánimo, o la percepción del dolor, entre otros.
Hasta ahora se han encontrado 2 receptores principales, el CB1 y el CB2, que son activados por lípidos neuromoduladores como la anandamida, el principal ligando endocannabinoide (análogo endógeno del THC del cannabis), o el 2-araquidonilglicerol (2-AG, análogo endógeno del cannabidiol/CBD, estando ambos involucrados en la regulación del apetito, el sistema inmune y el dolor). Los niveles de anandamida están regulados por la enzima ácido graso amida hidrolasa (FAAH por las siglas en inglés), que hidroliza la anandamida y la mantiene en niveles altos pero breves.
El receptor de potencial transitorio V1, también conocido como TRPV1, responde a endocannabinoides como la anandamida y la N-araquidonil-dopamina, por lo que se ha propuesto como un posible receptor adicional a los 2 anteriores. Los receptores TRPV1 están también en el SNP y SNC, y se encargan de la modulación del dolor. De hecho, la palmitoiletanolamida (PEA), uno de los cannabinoides endógenos más investigados (y que se ha planteado como tratamiento para el SII, ver apartado 4 de la guía) parece tener afinidad, entre otros, con los receptores TRPV1, más que con CB1 y CB2.
En la siguiente imagen, editada de la original de Hasenoehrl y cols. (2017), se aprecia la distribución habitual del sistema endocannabinoide en el tracto gastrointestinal:
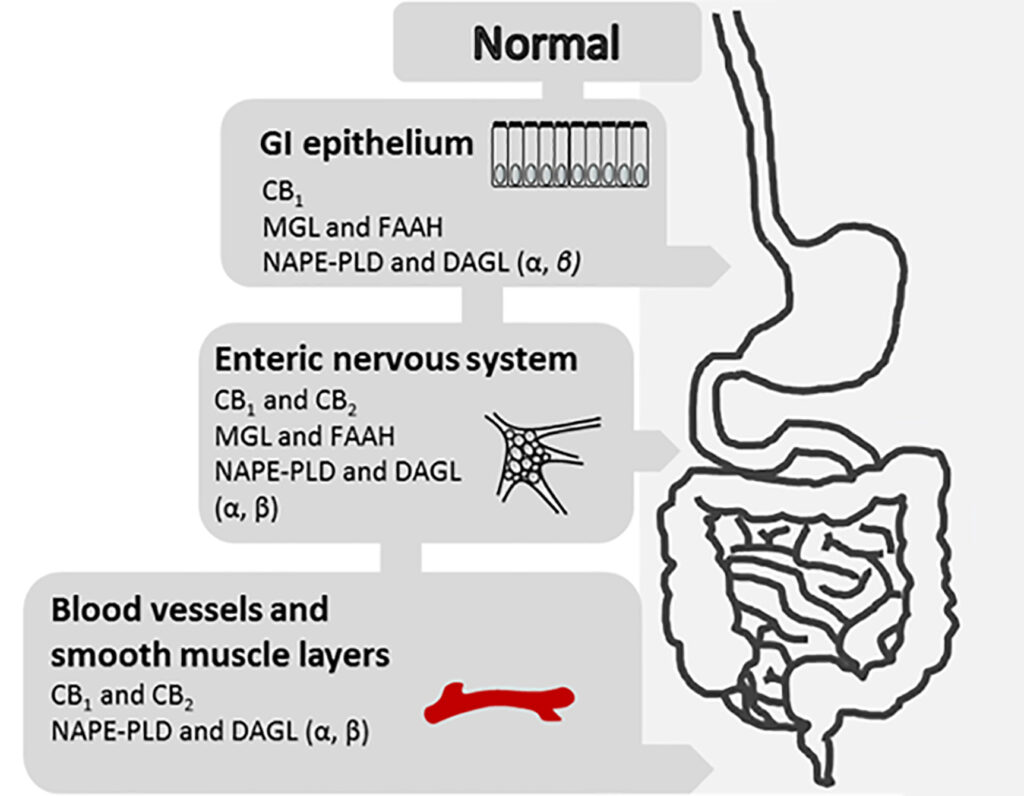
En pacientes con SII, un estudio de 2013, con una muestra pequeña, tomó a 3 grupos (controles sanos, SII-D y SII-E) y halló diferencias estadísticamente significativas entre los distintos grupos en los niveles en sangre de anandamida, 2-AG, PEA y oleoyletanolamida (OEA), y en los niveles de ARNm de FAAH (la enzima que degrada la anandamida) de biopsias de colon. Los SII-D tenían ↑2-AG, ↓OEA y ↓PEA, y los SII-E tenían ↑OEA y ↓FAAH (este última enzima medida por los niveles de ARNm en el colon). Los niveles bajos de PEA se asociaron con dolor abdominal de tipo calambre.
En otro estudio, de 2017, analizaron las biopsias de colon de 54 pacientes con SII (no especifica el tipo) y 12 controles sanos, encontrando que los SII tenían más mastocitos, ↓OEA y más receptores CB2. Otro estudio de 2019 replicó en parte estos resultados, encontrando, además de un aumento de receptores opioides mu (↑μ), ↑beta endorfinas (un neurotransmisor opiáceo endógeno), y más receptores CB2 en pacientes con SII (en todos los subtipos, teniendo las mujeres un número significativamente superior a los hombres, aunque en los controles sanos esta tendencia se invertía). Estos aumentos se localizaban sobre todo en células inmunitarias como los linfocitos T CD4+, lo que hizo a los autores plantear la hipótesis de que los niveles aumentados de estos receptores y ligandos se debían a que los sistemas opioide y cannabinoide actúan a través del sistema inmunológico para «compensar» de algún modo el dolor visceral del SII. Es posible entonces que estos hallazgos no sean un rasgo definitorio del síndrome, sino más bien una consecuencia, un mecanismo compensatorio del propio cuerpo para reducir la hipersensibilidad visceral y la activación inmunitaria&inflamación de bajo grado.
Receptores pruritogénicos
Un estudio de 2019 demostró la existencia de receptores pruritogénicos en el intestino humano. Los receptores pruritogénicos son los que median la percepción de la sensación de prurito (picor intenso, pudiendo llegar a cursar con dolor, a veces en ausencia de alteraciones orgánicas que expliquen esta sensación), y sabíamos que estaban presentes en nuestra piel, pero no en el intestino. Los autores aislaron neuronas del asta dorsal de seres humanos (los nervios que se insertan por detrás de las vértebras, transmitiendo al cerebro las sensaciones viscerales), y encontraron en ellas los receptores pruritogénicos TGR5 y MrgprX1. Su hipótesis es que una hiperactivación/aumento de estos receptores, en personas con SII y patologías afines, podría estar detrás de las sensaciones de dolor y molestia que estos pacientes experimentan. Para probar la hipótesis, estimularon a estas neuronas del asta dorsal con agonistas pruritogénicos, y observaron que, efectivamente, en personas con hipersensibilidad visceral, la respuesta de estas neuronas era superior a la normal. Este descubrimiento podría abrir la puerta a una nueva línea de investigación y tratamientos futuros, en forma de moléculas que bloqueen los receptores pruritogénicos a nivel intestinal.
En este vídeo (inglés), investigadores de la Flinders University resumen los hallazgos encontrados:
Canales de sodio dependientes de voltaje (NaV)
En este apartado nos hemos basado en una revisión de Erickson y cols. (2018) de donde hemos obtenido las principales referencias y las bases teóricas que seguidamente desarrollamos.
Los NaV son una familia de aproximadamente 9 canales (de NaV1.1 a NaV1.9), según los 9 tipos de subunidades alfa existentes, que se abren por cambios en la diferencia de potencial de la membrana plasmática. En las neuronas, estos canales son responsables de la despolarización que precede al potencial de acción (el impulso nervioso), pues permiten la entrada de sodio en la célula (Na+) a mayor velocidad de la que sale el potasio (K+). Los NaV inician este impulso nervioso en la mayoría de las neuronas, incluidas las fibras nerviosas aferentes primarias que transmiten el dolor.
Las alteraciones de algunos de estos canales se han vinculado con alteraciones en la percepción del dolor en humanos, y, de hecho, el consumo accidental de sustancias que activan estos canales, como P-CTX-1 (Pacific ciguatoxin 1) o veratridina, genera un cuadro de alteraciones gastrointestinales agudas asociadas con dolor abdominal (2006, 2010). Pese a ser potencialmente mortales, la administración de bloqueadores selectivos de los NaV, como la TTX (tetrodotoxina) o la neosaxitoxina, ha mostrado reducir la respuesta de diversas modalidades de dolor, incluyendo el dolor visceral en humanos (2011, 2015, 2017). Del mismo modo, el uso intrarrectal de lidocaína, un conocido bloqueador de los canales de sodio, en pacientes con SII, reduce la sensibilidad rectal y el dolor abdominal, sugiriendo que los NaV y la activación de terminaciones nerviosas en el colon juegan un papel clave en la patogénesis del dolor visceral de estos pacientes (2005).
A continuación indagaremos un poco en el rol de algunos canales de sodio específicos:
- NaV1.1: Un estudio de 2016 demostró que toxinas de la tarántula Heteroscodra maculata, bautizadas como Hm1a y Hm1b, activaban de manera selectiva estos receptores, provocando conductas de dolor en modelos animales y aumentando su sensibilidad a estímulos mecánicos (como podrían ser el paso de residuos y gases por el intestino humano), pero no termales. En un modelo animal (ratones) de SII, se observó que las fibras nerviosas mecanosensibles del intestino también tenían canales Nav1.1 y veían aumentada su sensibilidad cuando se cultivaban con Hm1a. Esto significa que el bloqueo selectivo de Nav1.1 podría tener aplicaciones terapéuticas en pacientes con dolor crónico e hipersensibilidad a estímulos mecánicos (como ocurre en el SII).
- NaV1.3: Tradicionalmente se asocian al dolor neuropático, aunque estudios más recientes han mostrado que también actúan en las células enterocromafines del epitelio intestinal (delgado y grueso) de ratones y humanos (2017, 2017, 2017). Estas células, gracias a las corrientes generadas por NaV1.3, podrían responder a la detección de estímulos mecánicos y químicos dentro del lumen intestinal (como ya vimos en el apartado sobre microbiota). Los otros 8 canales de sodio apenas se expresan en estas células ni en el resto del epitelio intestinal. Con todo, no hay un vínculo claro de NaV1.3 con el SII, pero como sí que se sospecha de un funcionamiento alterado de las células enterocromafines (y del eje microbiota-intestino-cerebro) en estos pacientes, los canales NaV1.3 podrían estar implicados en la patofisiología del SII de manera indirecta.
- NaV1.5: Son los que más evidencia tienen en SII en el momento actual. En seres humanos, estos canales han sido identificados en el músculo liso circular (no en el longitudinal) del yeyuno (2002, 2002, 2016), y también en el músculo liso circular del colon (2003), en las células intersticiales de Cajal del yeyuno (células que aparecen en el tracto digestivo y crean el potencial bioeléctrico de onda lenta, que regula la contracción de la musculatura lisa, 2003), y en el plexo mientérico (2014). Los canales NaV1.5 en la musculatura lisa podrían contribuir a la motilidad intestinal normal mediante la modulación de las ondas lentas y la contractilidad muscular (2002, 2007). De hecho la ranolazina, un tratamiento para la angina de pecho, inhibe la actividad del NaV1.5 en células musculares lisas del colon (2015), lo que explicaría el estreñimiento observado en tratamientos de larga duración (2008). Del mismo modo, mutaciones que implican una pérdida de función del gen SCN5A (que codifica los canales NaV1.5), se han asociado con el SII y el dolor abdominal (2009, 2014, 2017), aunque no está completamente claro si la relación es causal.
- NaV1.7: En un estudio de 2007 se encontró que biopsias rectales de pacientes con hipersensibilidad rectal parecen tener mayores niveles de NaV1.7 en las fibras nerviosas de las capas mucosa, submucosa y muscular. El estudio también describió cómo utilizando el marcador PGP9.5 se observaba una mayor expresión de NaV1.7 y una mayor ramificación nerviosa en la mucosa rectal, que podrían contribuir a la hipersensibilidad antes citada.
- NaV1.9: Una mutación (L811P) que aumenta la funcionalidad del gen SCN11A (el que codifica NaV1.9) fue identificada en 3 individuos con una insensibilidad congénita al dolor, y se asociaba con alteraciones graves de la motilidad, incluyendo episodios alternantes de diarrea y estreñimiento (2013, 2015).
