Sensibilización central y periférica
Cuando hablamos de sensibilización central y periférica, nos referimos a un proceso por el que un daño periférico provoca una sobreestimulación, la cual a su vez provoca una serie de cambios químicos en nuestro sistema nervioso periférico y central, y hace que el umbral del dolor disminuya. Este concepto se utiliza para explicar el dolor crónico, y también se ha propuesto para el SII-postinfeccioso. Es frecuente verlo aplicado en otros trastornos frecuentemente comórbidos al SII como la fibromialgia.
Empezaremos con la sensibilización central, basándonos en la revisión de Steeds (2016).
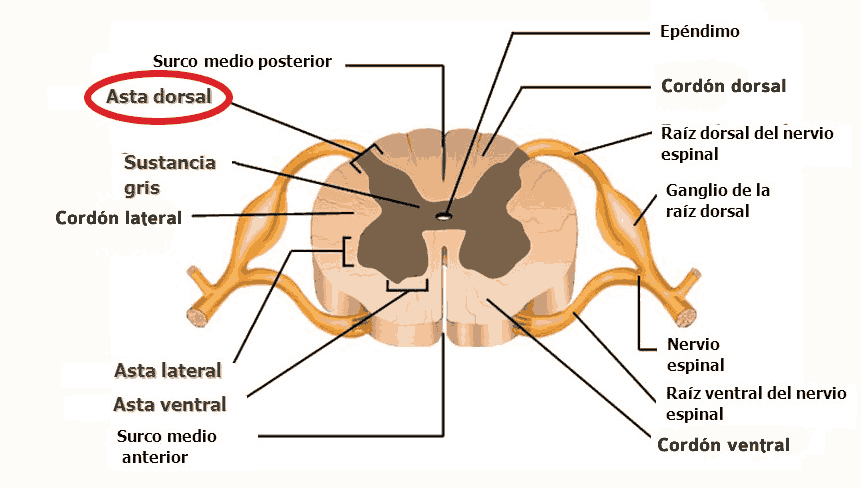
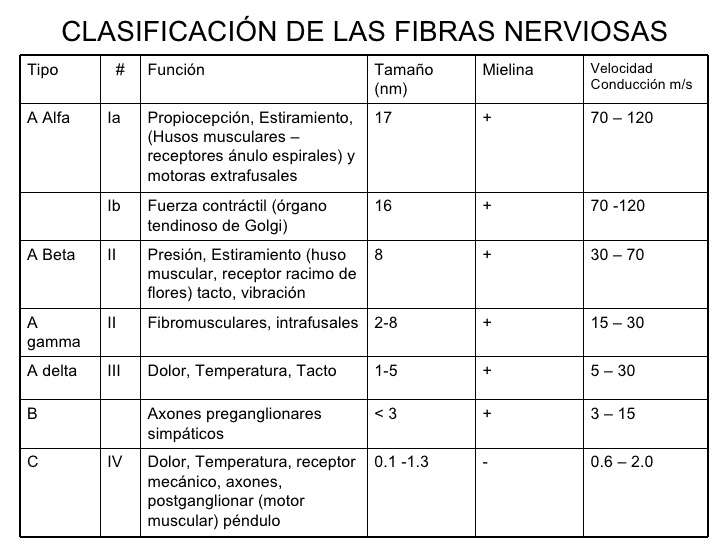
La sensibilización central tiene lugar cuando se producen cambios en el asta dorsal de la médula espinal (por donde pasan los nervios periféricos en su camino al cerebro) después de una lesión nerviosa. En el sistema nervioso, podemos clasificar las fibras nerviosas (axones) como fibras A, B y C. Concretamente, tenemos dos tipos de fibras primarias aferentes (que mandan la sensación del cuerpo al cerebro), las tipo A-delta o las C. Las A-delta están mielinizadas, son más rápidas, y responden a dolores tipo pinchazo, muy localizados e inmediatos, como pincharse con una aguja en la punta del dedo. Las fibras C no están mielinizadas y son más lentas, respondiendo a dolores más prolongados, inespecíficos y sordos, como si en otro dedo nos pegamos un porrazo y nos queda entumecido.
La activación repetitiva de las fibras C por estímulos nocivos conduce a una respuesta prolongada del asta dorsal. A este fenómeno se le denomina «liquidación». Dentro del asta dorsal, neurotransmisores inhibitorios como GABA o glicina trabajan para amortiguar la señal de dolor que se envía al cerebro, no obstante, en casos de «sensibilización central», la actividad de ambos neurotransmisores en el asta dorsal está reducida, y además, hay evidencias de muerte excitotóxica de interneuronas inhibitorias. Al mismo tiempo, o como consecuencia lógica de esto, se fortalecen las conexiones sinápticas excitatorias, lo que aumenta todavía más la señalización dolorosa. Los axones (fibras nerviosas) aumentan su proyección a las neuronas del tracto espinotalámico (que junto al tracto espinorreticular, es clave en la la transmisión ascendente del dolor). Este proceso implica cambios neuroquímicos mediados por N-metil-d-aspartato (NMDA, del que hablaremos más abajo), neuroquininas (de las que hablamos en el apartado del sistema nervioso entérico) y óxido nítrico.
El resultado de todos estos cambios es que se reduce el umbral sensorial para la señalización del dolor, y se extiende el campo receptivo. Es decir, si antes sólo nos dolía la punta del dedo, ahora también nos duele la falange y parte de la mano.
Además, se ha demostrado que se produce un recableado estructural en el asta dorsal de la médula espinal en respuesta a una lesión. El asta dorsal de la médula, de acuerdo a la clasificación de Rexed, se puede dividir en «láminas», y digamos que la lámina II, también llamada sustancia gelatinosa, es, junto con la V, un área clave para la modulación y localización del dolor. Las fibras C suelen desembocar en la lámina II, y las A-delta en las láminas I y V. Las fibras A-beta (diferentes de las anteriores, y encargadas del tacto «fino»/sutil y la vibración, sin relación con el dolor) pasan por el astra ventral sin hcer ninguna sinapsis y suben por las columnas dorsales, sin embargo, luego les van saliendo ramificaciones que llegan a las láminas III-V, y algunas que hacen sinapsis con fibras C en la lámina II. Todas estas fibras nerviosas, o axones, pertenecen a la primera neurona en la ruta ascendente del dolor, o neurona de primer orden, que luego describiremos.
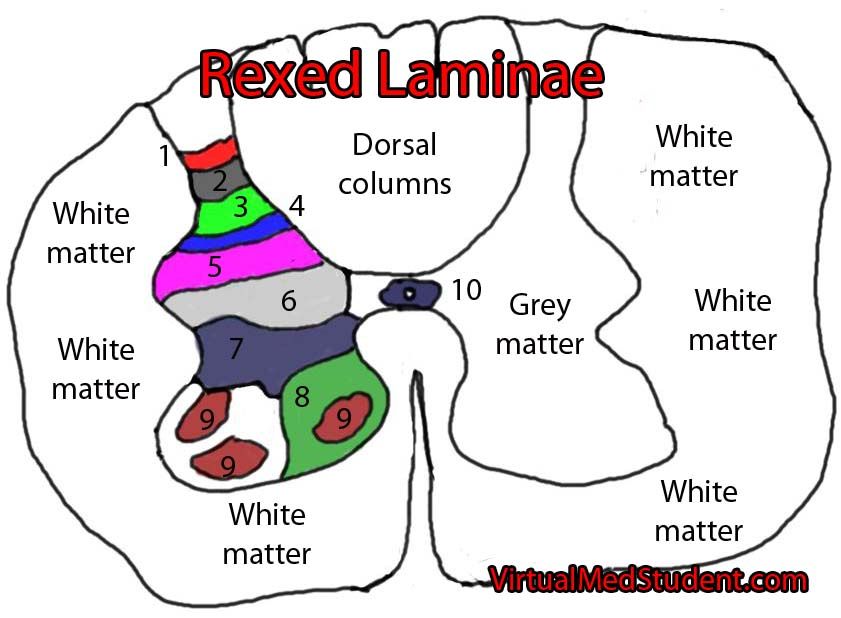
En casos definidos como «sensibilización central», tras una lesión periférica, las terminaciones de la fibra C en la sustancia gelatinosa (lámina II, donde suelen desembocar las fibras C) degeneran, y las ramificaciones de las fibras A-beta (tacto fino), que generalmente se encuentran en las láminas III y IV, desembocan en la lámina II. Esto podría explicar algunos casos de alodinia, donde estímulos táctiles «finos» y normalmente indoloros, como el roce de una sábana, se perciben como dolorosos. Estos cambios estructurales parecen deberse a una disminución del factor de crecimiento nervioso (NGF).
Finalmente, hay cambios a nivel supraespinal. Después de la lesión, hay evidencia de reasignación y reorganización cortical tanto en las cortezas primarias somatosensoriales y motoras como en las áreas subcorticales. Esto se reconoce bien después de la amputación de una extremidad, donde la falta de entradas aferentes de la extremidad amputada conduce a una menor ocupación del área correspondiente de la corteza somatosensorial. Como resultado, el área cortical vecina (que representa un sitio anatómico diferente) se expande. La manifestación clínica de estos cambios es que el paciente no solo desarrolla dolor en el miembro fantasma muy pronto después de la amputación, sino que también puede trazarse un mapa del miembro fantasma al tocar un sitio muy diferente de su cuerpo (por ejemplo, dolor en la mano fantasma que se siente al tocarse un lado de la cara). Se ha demostrado que la reducción de la intensidad del dolor del miembro fantasma mediante un tratamiento eficaz puede revertir los cambios corticales.
La sensibilización central todavía no se entiende demasiado bien, en el sentido de que no hay una explicación clara de por quunas personas la padecen y otras no. Posiblemente haya muchas enfermedades diferentes detrás de las alteraciones observadas en pacientes con esta condición. Pero una mejor comprensión de estos mecanismos periféricos, y sobre todo centrales, podría ayudar a conseguir mejores tratamientos. Una de las moléculas implicadas en los cambios neuroquímicos tras la sensibilización central es el NMDA, del que además hay algún estudio en SII, pudiendo mediar en los síntomas de sensibilización central de un subgrupo de pacientes, aunque la evidencia aún es muy débil. Para entender bien el papel del NMDA, primero hay que hablar de los receptores NMDA.
Los receptores NMDA o NMDAr (de N-metil-D-aspartato) son receptores celulares ionotrópicos que encontramos en las neuronas. Su activación provoca la apertura del canal iónico sin necesidad de proteínas G u otros mediadores (como ocurría en los metabotrópicos), y a través de este canal circulan cationes (iones con carga positiva) hacia el interior de la célula (como el sodio/Na+, o el calcio/Ca2+) y de la célula al exterior (potasio/K+). Normalmente la célula sufre un cambio de voltaje con la activación de los NMDAr, se despolariza, y transmite a las siguientes neuronas un potencial excitatorio postsináptico, que también las despolariza y facilita que se produzcan potenciales de acción o «impulsos nerviosos», muy importantes en la comunicación intercelular. Estos receptores se activan cuando se les unen a la subunidad NR2 neurotransmisores como el glutamato (el principal neurotransmisor excitatorio del sistema nervioso), la glicina, o la D-serina, (2006). Sin embargo, a diferencia de otros receptores de glutamato (receptores AMPA o receptores de kainato), el receptor NMDA, o NMDAr, es el único al que se une el NMDA, que actúa como análogo del glutamato. El rol de estos receptores en el SII no está del todo claro. Hay un estudio sobre el tema de 2012, donde demostraron que, en un subgrupo de pacientes de SII, la hipersensibilidad visceral (dolor) puede verse potenciada por estímulos dolorosos en otras partes del cuerpo, por ejemplo, estimulación con calor en las piernas. La relación era bidireccional, pues al generar de manera repetitiva una sensación molesta de distensión rectal, la tolerancia a los estímulos de calor en las piernas también se reducía, aunque todo esto sólo ocurría en la tercera parte de pacientes con SII (en los que se podría sospechar de mecanismos de sensibilización central). Los autores encontraron que el uso de un antagonista de NMDAr, el dextrometorfano, impedía la potenciación del dolor. Sin embargo, el dextrometorfano también es un inhibidor de la recaptación de serotonina entre otras cosas, y su efecto antagonista sobre NMDAr sólo ocurre a dosis altas (en el estudio usaron 60 mg), por lo que no se puede asegurar que sea específicamente su antagonismo de NMDAr el responsable de sus efectos.
En lo que respecta al óxido nítrico, otro de los mediadores clave en la sensibilización central, es una molécula sintetizada de la L-arginina por la enzima NO sintetasa, que tiene una isoforma inducible denominada iNOS o NOS2. En pacientes SII-D, se ha observado (2016) un mayor número de mastocitos con una expresión aumentada de iNOS en la mucosa del colon. Y en un modelo animal del mismo estudio, se observó cómo el óxido nítrico podía regular los niveles de determinadas citocinas, reduciendo los niveles de NGF (factor de crecimiento nervioso), que, como ya hemos visto arriba, es esencial para el desarrollo y supervivencia de las neuronas, especialmente de aquéllas que transmiten dolor, temperatura y sensación de tacto (fibras A-delta, C y A-beta). De hecho, la degeneración de las terminaciones de fibras C en la lámina II del asta dorsal de la médula, y el cambio de posición de las fibras A-beta de las láminas III y IV a la lámina II, son cambios estructurales descritos en la sensibilización central y muy relacionados con un déficit de NGF a este nivel.
Y con respecto a las neuroquininas, como ya mencionamos en el apartado sobre el sistema nervioso entérico, hay varios tipos, como la sustancia P (SP, péptido que regula la percepción del dolor) y las neuroquininas A (implicada en el dolor y los procesos inflamatorios) y B (implicada en la producción de gonadotropina o el embarazo). Se unen a los receptores NK1R, NK2R y NK3R, que se activan en células inmunes en situaciones de inflamación intestinal. El bloqueo de NK1R, al cual se une la sustancia P, ha demostrado ciertas mejoras sobre el dolor en modelos animales (2006), pero no está totalmente claro su rol en el SII. Algunos estudios (2013) han encontrado niveles más elevados de sustancia P en el colon de pacientes con SII-D (diagnosticados con Roma III), que podrían estar mediando la sensación de dolor.
CAMBIOS MOLECULARES CENTRALES/PERIFÉRICOS
Una explicación más técnica, y más centrada en las alteraciones bioquímicas presentes en la sensibilización central, pero también periférica, nos la da Daniel Orchard en la conferencia «Peripheral and Central Sensitization».
Tras una lesión inicial en alguna zona de la periferia del cuerpo, pongamos que nos quemamos la punta del dedo, los nociceptores de la zona empiezan a liberar neuropéptidos, llevando a una inflamación neurogénica de la zona, que afecta no sólo a la parte quemada, sino también un pequeño perímetro alrededor de la misma. El tejido quemado (tejido A) se vuelve hipersensible temporalmente al roce y al calor, en un proceso llamado hiperalgesia primaria (si los estímulos dolorosos ahora duelen más) o alodinia primaria (si los estímulos inocuos ahora empiezan a doler). A esto nos referimos cuando hablamos de sensibilización periférica (a una mayor sensibilidad de las aferencias nerviosas).
El tejido adyacente (tejido B) se vuelve menos sensible al calor, en un proceso llamado hipoalgesia térmica, que más adelante explicaremos.
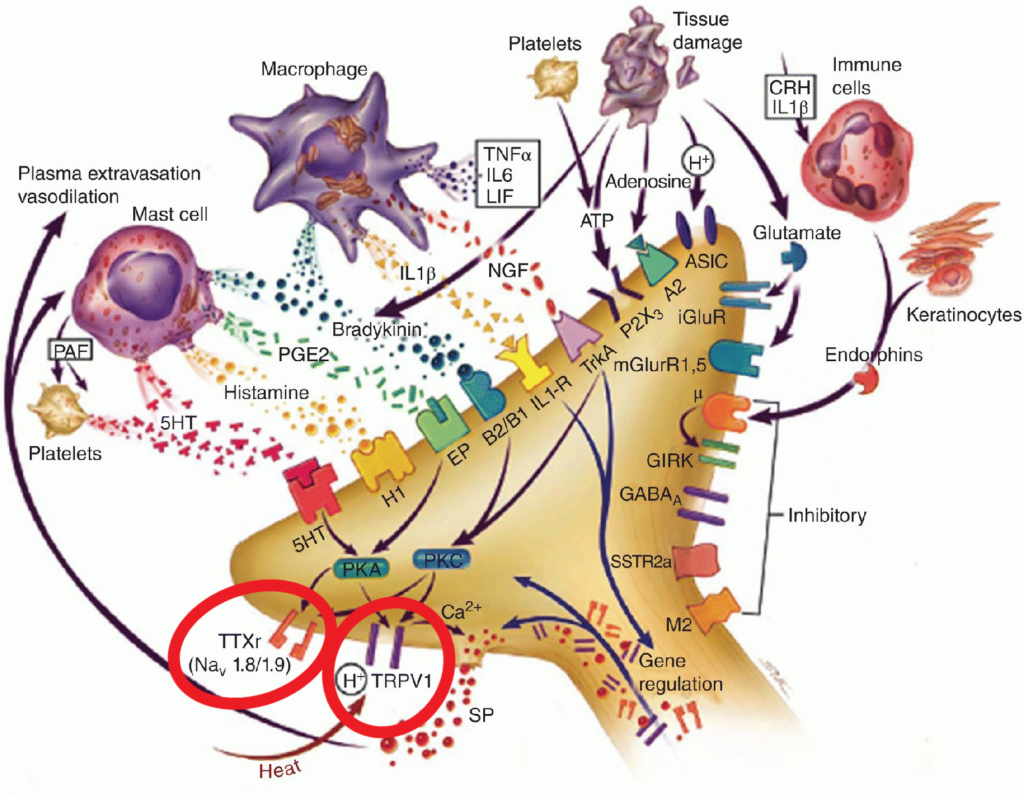
En la imagen se describen algunos cambios neuroquímicos que pueden provocar sensibilización periférica a través de la regulación al alza de receptores ya existentes (algo que se ha descrito repetidamente en la investigación del SII, sobre todo con los TRPV1, tenemos el mismo número de receptores, pero más sensibles). Podemos ver cómo todo tipo de mediadores proinflamatorios como la serotonina (sí, la serotonina de la mucosa puede ser proinflamatoria, frente a la encontrada en la sinapsis), la histamina, la prostaglandina E2, la bradiquinina, citocinas proinflamatorias, factor de crecimiento nervioso (sí, también puede ser proinflamatorio)…liberados por mastocitos y macrófagos, otras células inmunitarias o el propio tejido dañado, se unen a diversos receptores y provocan alteraciones en cascadas bioquímicas de enzimas y proteínas, mediadas por las PKA y PKC (proteínas kinasas A y C), que acabarán sensibilizando o «regulando al alza» los canales iónicos que responden a ácidos/químicos/estímulos mecánicos (TRPV1) y los canales de sodio mediados por voltaje específicos de los nociceptores (NaV1.8 y 1.9). Tras esta sensibilización, ambos receptores serán más sensibles a los estímulos, y el potencial de acción (la señal que «dispara» a la neurona y le hace mandar el impulso nervioso) se activará con mucha menos estimulación externa.
Todo este proceso ocurre por cambios locales en los receptores de las terminaciones nerviosas periféricas, y explica por qué el tejido quemado del que antes hablábamos (A) ahora se vuelve más sensible al roce o al calor. Algo parecido ocurre en el SII, donde estímulos que antes eran inocuos, como el tránsito de gases o materia fecal, de repente se vuelven molestos, o incluso intolerables.
Otro modo de contribuir a la sensibilización periférica es mediante la regulación al alza de nuevos receptores. El ganglio de la raíz dorsal (GRD, DRG en inglés) de la médula contiene los cuerpos celulares de las neuronas aferentes de los nervios espinales (2011).
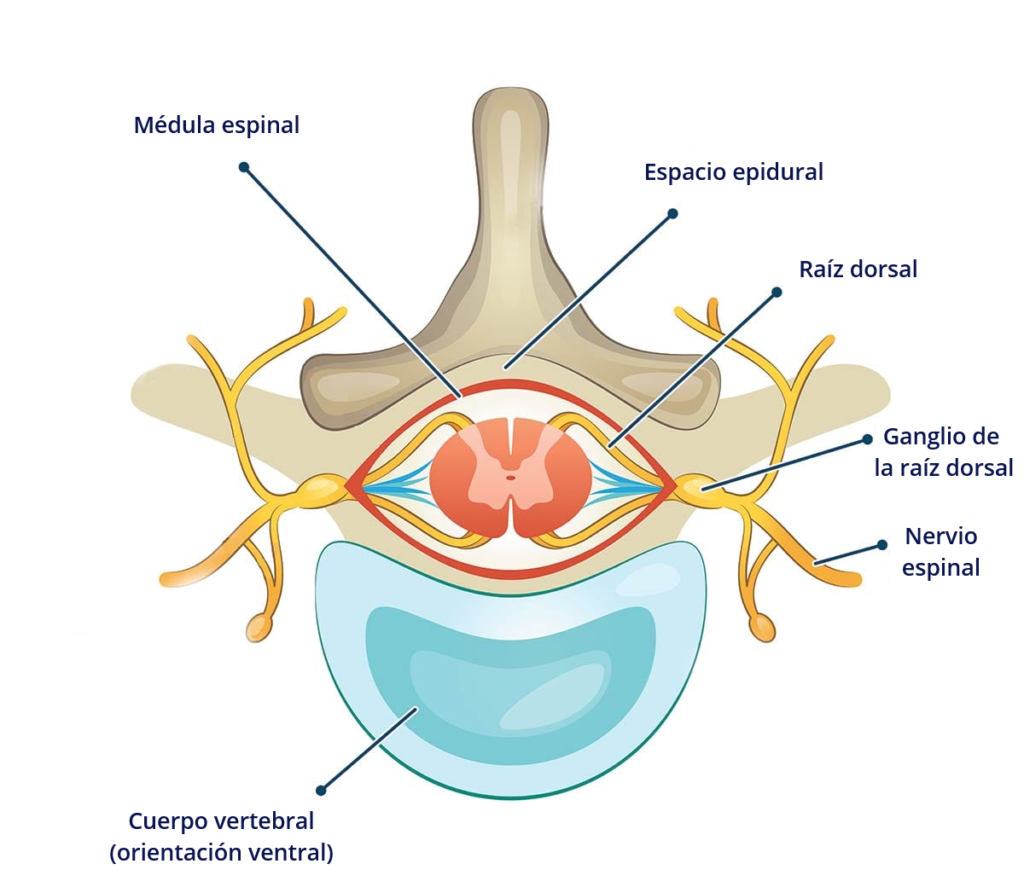
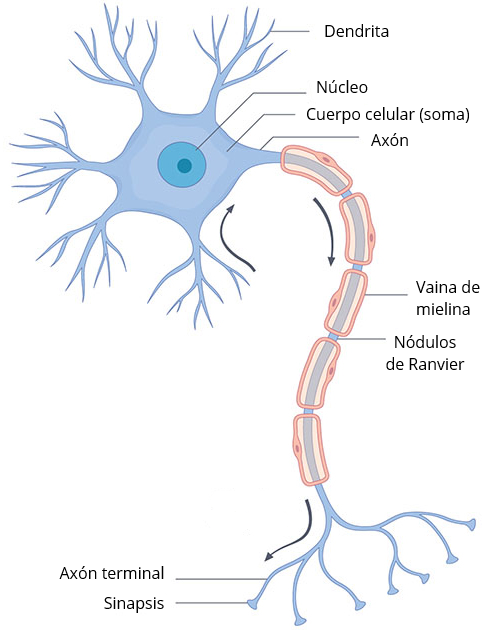
Cuando decimos «cuerpos celulares» de las neuronas, no nos estamos refiriendo a la totalidad de la neurona. Las neuronas tienen 3 partes, el cuerpo celular o soma, donde reside el núcleo, las dendritas, que cumplen una función receptora, y los axones, que principalmente se dedican a transmitir el impulso nervioso. En torno a las neuronas también solemos ver las células de glía, que se dedican a proteger la neurona, ayudarle en la obtención de nutrientes, regular neurotransmisores, o crear la mielina alrededor de algunos axones, un recubrimiento que contribuye al desplazamiento de los impulsos nerviosos. Los nódulos de Ranvier son pequeñas interrupciones en la mielina que exponen al axón, y que permiten que el potencial de acción de desplace a mayor velocidad saltando de un nódulo a otro, gracias a células gliales como las células de Schwann en el sistema nervioso periférico y los oligodendrocitos en el SNC.
Las neuronas normalmente miden menos de 0.1 milímetros, pero, en el sistema nervioso periférico (que en este caso también incluye al intestinal/entérico), cada neurona es una fibra nerviosa que puede llegar a medir más de un metro. Las neuronas que pasan por el ganglio de la raíz dorsal, concretamente, son pseudounipolares, lo que significa que, en vez de tener un axón y una dendrita separados por el cuerpo celular, la única protuberancia del cuerpo celular es un axón que se divide en dos: una parte va a los órganos en la periferia, y está en contacto con la mucosa intestinal, o con los tejidos del dedo que nos quemamos en el ejemplo anterior (y responde al calor, tacto, estímulos químicos…) comportándose como una dendrita (al menos en teoría), y otra parte se dirige a la médula espinal (enviando el impulso nervioso al SNC), mientras el cuerpo celular se extiende a través del ganglio de la raíz dorsal y se inserta en el asta dorsal de la médula.
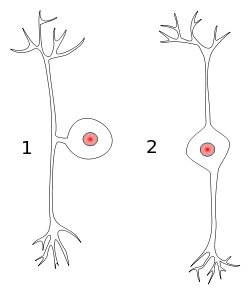
2: Neurona bipolar.
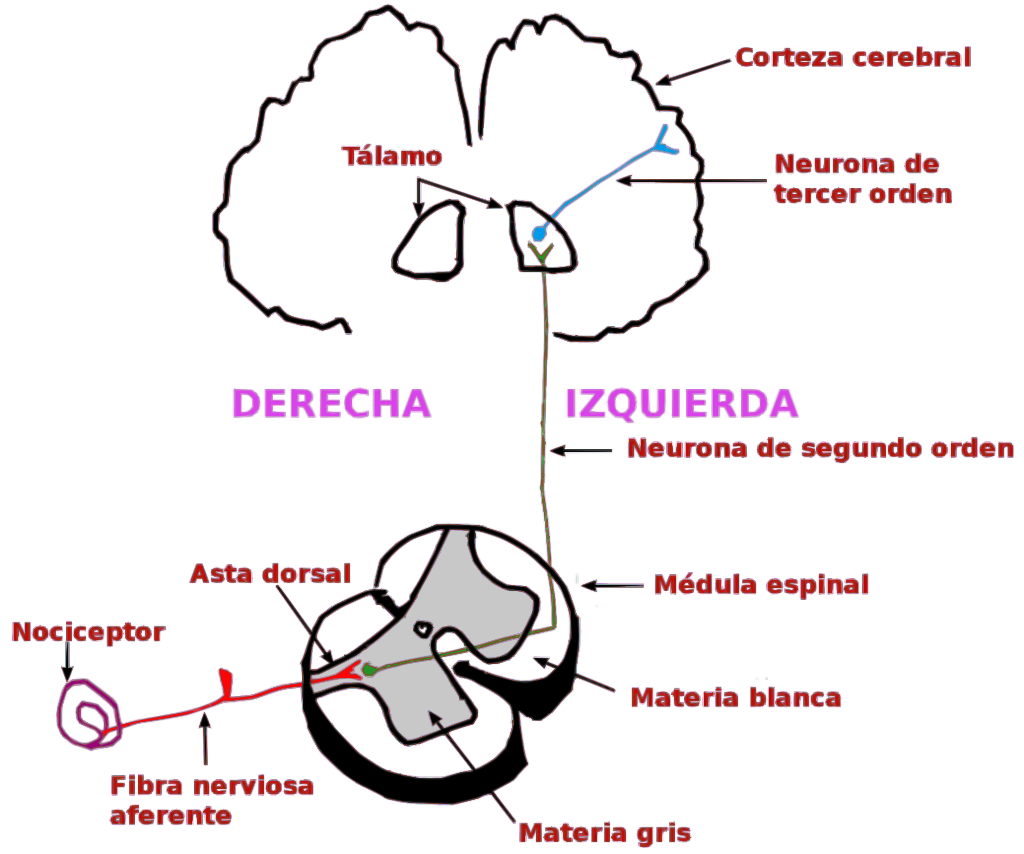
Los axones ascendentes del DRG, que contienen fibras nerviosas aferentes, se utilizan en la transducción de la información somatosensorial (la transducción en el SN es un proceso por el que un estímulo físico se convierte en un potencial de acción (básicamente, un impulso nervioso) que se transmite a lo largo de los axones hacia el SNC para su integración. Estas neuronas de las que hemos hablado hasta ahora son neuronas de primer orden, y visualmente, son como hilos que van desde distintos puntos del intestino hasta insertarse todos juntos por detrás de las vértebras, formando un grueso cordón a este nivel (ganglio de la raíz dorsal), que luego manda sus proyecciones a otras neuronas de la médula espinal. Pero cada hilo sería una neurona. Después vienen las neuronas de segundo orden, que conectan con éstas en las astas posteriores de la sustancia gris de la médula espinal (lo que vendrían a ser las primeras láminas de Rexed que antes comentábamos), y que también tienen una longitud considerable, recorriendo toda la médula hasta alcanzar a las neuronas de tercer orden en estructuras subcorticales del cerebro, como el tálamo, las cuales llevan la señal directamente a la corteza cerebral. Es decir, que desde que nos quemamos el dedo, o algo estimula nuestra mucosa intestinal, tan sólo 3 neuronas podrían ser suficientes para transportar esa señal hasta la corteza cerebral (2021).
Pues bien, volviendo a la sensibilización central, en personas sanas, si miramos el ganglio de la raíz dorsal, en el soma de estas neuronas periféricas de primer orden se producen por transcripción y traslación diversos componentes como ARN, ARN mensajero, aminoácidos, polipéptidos…y se envían tanto al axón terminal periférico (en contacto con la mucosa intestinal, o con cualquier tejido periférico como el del dedo que nos habíamos quemado) como al axón terminal «central» (desde donde saldrá el impulso nervioso, dirigido al SNC), para crear receptores TRPV1. Sin embargo, en casos de sensibilización central, un exceso de mediadores como el NGF (factor de crecimiento nervioso) provocan que esta producción de TRPV1 se multiplique en ambos puntos, con el consiguiente aumento de la sensibilidad. Antes vimos cómo podía aumentarse la sensibilidad poniendo los receptores TRPV1 en un estado de «hiperreactividad», ahora hemos visto cómo hacerlo aumentando el número de receptores.
Ya hablamos antes de la alodinia, un síntoma muy frecuente en diversos trastornos de dolor crónico, especialmente en dolores neuropáticos. Este término se refiere a la sensación de dolor elicitada por estímulos que normalmente no son dolorosos (por ejemplo, el roce de una sábana). En el SII ocurre algo parecido, pues la sensación visceral normal de repente se torna insoportable. Existen experimentos para definir la alodinia primaria, donde los mecanorreceptores en el área A (la parte del dedo que nos hemos pinchado con una aguja), que ha recibido un daño y ahora tiene diversos mediadores proinflamatorios, se vuelven más sensibles a estímulos mecánicos que antes no elicitaban ninguna respuesta. La inyección de determinados químicos con propiedades inflamatorias ha demostrado ser capaz de producir una respuesta de alodinia primaria a estímulos mecánicos en el área de la inyección (A), aunque el área adyacente, no afectada por la inyección (área B) no alteraría su sensibilidad. Podríamos decir que este proceso es mediado principalmente por el SNP, siendo una sensibilización periférica.
En la alodinia, cosas que antes no dolían ahora duelen. Pero también puede pasar que cosas que antes dolían ahora duelan mucho más, y a esto se le llama hiperalgesia. La hiperalgesia primaria sería más o menos similar a la alodinia primaria, simplemente estímulos que antes dolían, ahora duelen mucho más cuando hay contacto con el área lesionada (A). Seguiría siendo un proceso principalmente periférico. Sin embargo, a veces la cosa se complica, y hablamos de una hiperalgesia secundaria, donde el SNC podría estar implicado. En este caso, pongamos que nos quemamos el dedo, y el área lesionada (A) se vuelve más sensible a estímulos dolorosos puntiformes (mecánicos) y al calor/frío (estímulos termales). Sin embargo, el área adyacente (B) también se vuelve más sensible a estos estímulos mecánicos, pero no así al calor o frío. Este hecho no puede explicarse con lo que a día de hoy sabemos del sistema nervioso periférico. Al principio de este apartado, mostramos una gráfica con los tipos de fibras nerviosas (axones). En esta gráfica se explica que los estímulos mecánicos dolorosos y los estímulos termales son trasportados por el mismo tipo de fibras (A-delta y C). No hay fibras que transporten sólo estímulos mecánicos dolorosos, o sólo estímulos termales. Por tanto, y volviendo a nuestro ejemplo, si yo me quemo un dedo, y la zona adyacente a la quemadura se vuelve más sensible a estímulos mecánicos, podría pensarse en una alteración de las fibras A-delta o C…pero si no hay un aumento de la sensibilidad al calor o frío, significaría que estas fibras están funcionando adecuadamente. Entonces, ¿qué causa el aumento de sensibilidad a estímulos mecánicos? Una posible respuesta sería: el sistema nervioso central. Se sospecha que, ya que el sistema nervioso periférico aparentemente está bien, el «fallo» debe estar en el SNC, probablemente en las conexiones sinápticas a la altura del asta dorsal de la médula.
