Alteraciones psicosociales y eje HPA
Cuando se diagnostica un trastorno funcional digestivo (como el intestino irritable) a veces se les dice a los pacientes que es todo «de los nervios» y que su problema es una somatización.
Si bien es cierto que hay casos en los que el estrés se asocia al origen y/o empeoramiento del cuadro, también es cierto que no «todo» son los nervios, y que muchas veces éste es el recurso fácil de algunos médicos cuando, por el motivo que sea, no son capaces de decirle al paciente que sencillamente no saben qué es lo que tiene, y que la medicina actual llega hasta donde llega y por desgracia no puede explicarlo todo. Un médico actualizado en SII y trastornos funcionales digestivos no va a negar la complejidad de las interacciones cerebro-intestino, y normalmente reconocerá que los factores psicológicos pueden influir en la experiencia de la condición. No obstante, no la reducirá a «los nervios», porque eso supondría negar la organicidad en un síndrome cuya naturaleza es, como mínimo, multifactorial.
Muchos de los antiguos casos de intestino irritable (que a menudo se achacaban a «los nervios» o a estados mentales que muchas veces eran más una consecuencia que una causa del estado del paciente), a día de hoy son celíacos, sensibles al gluten/trigo, intolerantes a la fructosa/sorbitol, tienen malabsorción de sales biliares, colitis microscópica…ya no son «los nervios», pero es que antes tampoco lo eran. Simplemente ahora sabemos lo que tienen y antes no lo sabíamos. Esto no significa que los factores psicosociales no jueguen un rol en la enfermedad, habrá subgrupos de pacientes en los que influyan y otros subgrupos en los que no.
La WGO resume perfectamente el rol de los factores psicosociales con unas palabras que hoy son compartidas por todas las instituciones oficiales de gastroenterología:
El SII no es un trastorno psiquiátrico ni psicológico. Sin embargo, hay factores psicológicos que pueden intervenir en:
1. La persistencia y la percepción de gravedad de los síntomas abdominales.
2. Contribuir a empeorar la calidad de vida y el uso excesivo de servicios de salud.
VARIABLES PSICOSOCIALES EN LA INSTAURACIÓN DEL SII
En un estudio de 1988 se observó que, en pacientes con dolor abdominal de causa desconocida (para los medios del momento), los eventos más habituales antes de debutar con su condición habían sido la terminación de relaciones cercanas, el divorcio, la marcha del hogar de un miembro de la familia, o la ruptura en una relación seria novio-novia. También se comprobó que la dificultades interpersonales, como problemas matrimoniales graves o tensiones familiares/domésticas extremas, eran mucho más frecuentes en pacientes con dolor abdominal funcional que en pacientes con enfermedades gastrointestinales orgánicas, o individuos de la comunidad. Sin embargo, es evidente que no todos los divorcios o problemáticas familiares desembocan en un problema médico, y en caso de hacerlo, no necesariamente será un SII.
En 2016 se publicó un estudio que encontró que la probabilidad de desarrollar un SII-postinfeccioso (que aparece a raíz de una gastroenteritis infecciosa) aumentaba en personas con susceptibilidad a tener diarrea en momentos de estrés, que tenían algún síntoma somático (queja física médicamente inexplicada), o que tenían ansiedad ante la enfermedad. Que la ansiedad se relacione con el SII no es algo nuevo, sabemos que los trastornos de ansiedad son un reconocido factor de riesgo para el desarrollo futuro de un SII (2003).
Asimismo, existe una relación entre las experiencias adversas en la infancia (como el maltrato) y el SII, y éstas se asocian a un mayor riesgo de padecerlo (1994, 2010, 2010, 2019, 2020). Se han encontrado datos semejantes en víctimas de abusos sexuales, aunque hay que tener en cuenta que el abuso infantil físico/sexual/emocional correlaciona con TODO TIPO de enfermedades en la adultez, como pueden ser la isquemia, el cáncer, la enfermedad pulmonar obstructiva crónica (EPOC), el infarto, la diabetes, la hepatitis, la ictericia (2015), el asma, las enfermedades cardiorrespiratorias, las infecciones (2010) y los «problemas de salud» en general (2009). De acuerdo a estos estudios, cuando el abuso ha sido de tipo sexual/físico, sí hay una asociación importante con el dolor crónico en la zona pélvica/abdominal, síntomas genitourinarios, fatiga y dolores de cabeza. Pero, ¿es el maltrato la causa última de estas patologías? No, igual que tampoco es la causa última del cáncer, la diabetes, la EPOC, o el resto de enfermedades antes mencionadas. En la actualidad, hay suficiente evidencia científica para considerar que el estrés y las variables psicosociales pueden tener un efecto mediador en las enfermedades orgánicas, pudiendo desencadenar la enfermedad en personas que ya tenían una predisposición previa, pero no hay evidencia suficiente para considerarlo una causa de éstas (American Psychological Association, 2013).
Ya hemos visto que el estrés puede ser el precipitante de muchas enfermedades, sin convertirlas por ello en somatizaciones. Enfermedades dermatológicas, alérgicas, cardíacas, endocrinas…no sólo las digestivas. Y en estos casos, una vez la enfermedad «brota», se vuelve crónica. En los estudios con ratas sobre SII, los científicos necesitan tener ratas que sufran de SII para experimentar con ellas. ¿Cómo se lo provocan? Aunque suena muy cruel, un método muy común es estresarlas, por ejemplo, mediante descargas eléctricas, o mediante inyecciones con determinados químicos, hasta llevarlas a un límite en el que el SII «brota». Una vez lo han adquirido, no importa lo relajadas o despreocupadas que puedan estar, el síndrome permanece durante toda su vida. Con seres humanos ocurre algo parecido, el SII frecuentemente «brota» en épocas de estrés intenso y sostenido, pero, si está bien diagnosticado conforme a los criterios de Roma IV, el SII suele evolucionar y cronificarse, no desaparece del todo, aunque la persona vuelva a un estado emocional de relajación (la excepción sería el SII-postinfeccioso, donde el 50% de los casos se curan espontáneamente en los 5-6 años posteriores a la infección, y también hay algunos casos de SII que pueden tener remisiones puntuales, pero en estos últimos los síntomas pueden regresar en cualquier momento).
VARIABLES PSICOSOCIALES EN EL MANEJO DEL SII
El estrés psicosocial tiende a empeorar de manera consistente la sintomatología, a través de diversos mecanismos. Los pacientes de SII tienen una mayor tendencia a las catastrofizaciones (2000), y se cree que estas catastrofizaciones podrían modular la experiencia cognitiva del dolor en algunos pacientes (2004) (este mecanismo ocurriría en ambos sexos, pero en el caso de las mujeres parece que una mayor catastrofización en situaciones experimentales de dolor se asocia con una menor activación de los controles inhibitorios nocivos difusos, un mecanismo neurofisiológico de inhibición endógena del dolor).
De igual manera, sabemos que el estrés emocional puede aumentar la severidad del dolor (2011), la distensión abdominal (2001), o la diarrea (2014).
Otro aspecto donde entran los factores psicológicos es el efecto placebo. Los pacientes con SII tienen una respuesta al placebo excepcionalmente alta, como se desprende de un metaanálisis de 2010 con más de 8.000 pacientes, que encontró tasas de respuesta al placebo que rozaban el 40% (cifra que coincide con la «media» encontrada en los ECAs de SII). Este estudio, no obstante, usó los antiguos criterios de Roma III, por lo que las cifras de respuesta al placebo con los criterios Roma IV podrían diferir. En 2018 se encontró que, en mujeres diagnosticadas con criterios aún más antiguos (Roma II), la respuesta al placebo aumentaba especialmente cuanto mayor era el dolor abdominal, pero, sobre todo, cuanto mayor era la variabilidad de ese dolor en el día a día de la vida de las pacientes (lo que haría más probable que se atribuyeran al fármaco variaciones en el dolor habitual que realmente no tendrían nada que ver con éste).
Para combatir el efecto pernicioso de estas variables, se han propuesto diversas intervenciones psicológicas con un buen bagaje de evidencia científica a su favor, como la terapia cognitivo conductual o la hipnoterapia dirigida al intestino (ver apartado «Para el estrés», en la pestaña «Tratamientos»). Sin embargo, aunque muchos pacientes pueden beneficiarse de ellas, en otros casos estas intervenciones no ofrecerán un alivio suficiente, y en algunos directamente no servirán de nada, teniendo que recurrir a intervenciones dietéticas y farmacológicas. Algunos estudios recientes investigan mecanismos de detección temprana de los pacientes que sí podrían beneficiarse de una intervención psicológica (2018).
¿QUÉ FUE ANTES, EL HUEVO O LA GALLINA?
Sabemos que trastornos como la ansiedad generalizada, el trastorno de pánico, el estrés postraumático y la depresión (2005, 2010), o rasgos de personalidad como el neuroticismo (inestabilidad emocional, tendencia a experimentar emociones negativas) y la alexitimia (dificultad para identificar y describir emociones, constricción de los procesos imaginativos) son más frecuentes en pacientes con diagnóstico de SII (2003, 2006), aunque esto no implique necesariamente una relación causal.
Sin embargo, hay que tener en cuenta que la relación cerebro-intestino es bidireccional, y las alteraciones psicológicas también pueden ser una consecuencia, más que un factor de riesgo, de los síntomas abdominales. Se ha demostrado que el diagnóstico de SII-postinfeccioso (provocado por una gastroenteritis infecciosa) puede predisponer a desarrollar un trastorno mental en el futuro (2015), y que en pacientes con trastornos afectivos y SII, este último, más que sucederlos en el tiempo, frecuentemente los precede (1996). Y se han reportado conductas suicidas con una frecuencia 2-4 veces superior a la normal en pacientes con SII (2017), relacionadas con el dolor abdominal constante, relación que se mantiene con independencia de que exista una depresión comórbida. Del mismo modo, son frecuentes las conductas evitativas en pacientes con SII-D (IFFGD, 2005) que aparecen como consecuencia de la enfermedad, pues temen no poder controlar sus síntomas en situaciones sociales (aunque pueden llegar a volverse irracionales, en cuyo caso se pueden beneficiar de técnicas conductuales de exposición y terapia cognitivo conductual), o en pacientes de SII con dolor abdominal muy marcado, que acaban evitando trabajos, tareas domésticas, actividades de socialización/ocio y relaciones sexuales (2016).
Recientemente, un estudio belga con más de 13.000 pacientes con diagnóstico de SII (2019) encontró que los trastornos psicosociales comórbidos (así como los síntomas e infecciones urogenitales, los síntomas musculo-esqueléticos y otros síntomas somáticos comórbidos con el SII) debutaban en los mismos años que éste, sin precederlo o sucederlo en el tiempo, lo que podría sugerir que, más que «provocarse» los unos a los otros, exista una alteración subyacente que sea común a estos problemas y que se manifieste de diferentes formas. En otras palabras, que es posible que después de todo tengamos menos control del que pensamos, y ambas cosas, tanto la probabilidad de desarrollar un trastorno psicosocial como la probabilidad de desarrollar un SII, vengan ya predeterminadas desde el nacimiento, más que explicarse la una a la otra. Un estudio de 2021, que analizó el genoma de más de 50.000 pacientes, llegó a una conclusión similar, encontrando 4 genes que podrían predisponer al desarrollo tanto del SII como de problemas emocionales diversos, siendo ambos consecuencias de una alteración genética común, y no teniendo que existir una relación entre el SII y los síntomas emocionales.
Una revisión sobre el tema de 2020 se posiciona en la línea de este último estudio, empieza diciendo que unas veces los problemas digestivos parecen ser promovidos por factores psicológicos, y otras veces los problemas psicológicos parecen ser promovidos por factores digestivos, para luego concluir que «la evidencia emergente sugiere que mecanismos biológicos subyacentes pueden explicar la asociación del malestar psicológico con los trastornos funcionales gastrointestinales».
EL SII Y LAS «SOMATIZACIONES»
A día de hoy no existe un marcador biológico para diagnosticar esta condición, una «huella física» específica de pacientes con SII, y aunque en otras condiciones que tampoco tienen marcadores (como el resfriado común) no se acepta la idea de la somatización (es poco plausible que una nariz llena de mocos sea fruto de los nervios, aunque la investigación nos diga lo contrario), en los trastornos funcionales digestivos esta idea preconcebida es más habitual, algo debido en parte a la metodología utilizada en los estudios que vinculan SII y somatización.
Hay numerosos estudios, muchos de ellos en revistas de impacto, que han asociado el SII con una mayor probabilidad de sufrir «trastornos de somatización». Sin embargo, una vista más profunda a estos estudios nos revela que el término «somatización» no está bien delimitado y se confunde a menudo con síndromes comórbidos con el SII. Lo vemos con más detalle en estos 3 ejemplos:
Ejemplo 1. Un estudio de 2015 analizó la relación entre los niveles de somatización y los síntomas del SII, encontrando que los SII-M tenían los niveles más altos, y que la hinchazón era el síntoma más relacionado con esta variable. Otro estudio prospectivo de 2016 mostró que la somatización en pacientes con SII se asociaba con un aumento de los síntomas posprandiales (después de las comidas). El instrumento empleado para medir los niveles de somatización en ambos estudios fue la escala de síntomas somáticos del «Patient Healt Questionnaire», la diferencia es que el primer estudio utilizó el PHQ-12, que excluye los 3 síntomas gastrointestinales de la lista, y el segundo utilizó el PHQ-15, que incluye el listado completo. Cuando leemos la escala con detenimiento, podemos ver que se valoran como somatización síntomas como «dolor de espalda», «dolor de cabeza», «dolor o problemas durante el coito», «dolor en brazos, piernas o articulaciones», «sensación de cansancio o falta de energía», «calambres menstruales»…
Ejemplo 2. Otro estudio, de 2002, encontró evidencia para un modelo causal por el que el abuso infantil lleva a la disociación, después a la somatización, y finalmente al SII. El instrumento utilizado en esta ocasión fue la escala de somatización del «Hopkins Symptom Checklist». Si miramos en profundidad los ítems de esta escala, nuevamente valoran como somatización síntomas como «debilidad», «dolor de cabeza» o «sensación de falta de energía».
Ejemplo 3. Otro estudio, de 2003, mostró que en pacientes con SII, niveles altos de somatización se asociaban con peor sintomatología, y abogaba por una etiología psicológica que explicara la somatización. El instrumento utilizado en este estudio fue la escala de somatización del «Symptom Checklist-90-Revised» (SCL-90-R), que incluye como síntomas de somatización «dolores de cabeza», «dolores en la parte baja de la espalda», «náuseas o malestar en el estómago», «dolores musculares» o «sentirse débil en alguna parte del cuerpo».
Tras leer todo esto, hay que recordar que el SII es un síndrome con diversas comorbilidades. La dispepsia funcional (CIE-11: DD90.3), que explicaría el ítem «náuseas o malestar en el estómago», puede ocurrir aproximadamente en el 40% de pacientes con SII (2019). Otras comorbilidades frecuentes del SII son la migraña (CIE-11: 8A80.2), que explicaría el ítem «dolores de cabeza», o la fibromialgia (CIE-11: MG30.01), que explicaría los ítems «dolores musculares» o «dolores en brazos, piernas o articulaciones» (2006). Otras condiciones, como el Síndrome de Fatiga Crónica (Encefalomielitis Miálgica, CIE-11: 8E49) o la disfunción sexual (CIE-11: HA01.Z) también son frecuentes en pacientes con SII (2010), y explican ítems como «sensación de falta de energía», «sentirse débil en alguna parte del cuerpo», o «dolor o problemas durante el coito». Y también tenemos la dismenorrea (CIE-11: GA34.3), que explica el ítem «calambres menstruales» y que es también un síndrome comórbido con el SII (2012).
El problema de estos estudios es precisamente que todas estas condiciones (o sus síntomas) pueden ser fácilmente confundidas con somatizaciones, cuando estamos hablando de condiciones médicas reconocidas y validadas por la OMS (se puede ver el código CIE-11 junto a cada una de ellas). Por tanto, cuando escuchamos que «el SII se vincula con los trastornos de somatización», no es descartable que con «somatización» se estén refiriendo a comorbilidades frecuentes de este trastorno funcional. A la hora de leer estudios de este tipo, podría ser útil valorar:
- Que se excluyan ítems como el «malestar estomacal» o el «dolor de cabeza», en pacientes de SII que también sufren dispepsia funcional o migraña, respectivamente, o los ítems que correspondan a otras condiciones asociadas.
- Que el estudio se realice sólo con pacientes de SII sin otras comorbilidades asociadas (aunque existe la posibilidad de que estos pacientes no estén diagnosticados de otras condiciones pero sí tengan manifestaciones subclínicas de, por ejemplo, dispepsia, lo que puede dificultar la distinción con las somatizaciones).
- Que se utilicen técnicas de entrevista para que el evaluador pueda investigar en profundidad si los síntomas realmente obedecen a causas principalmente -nunca exclusivamente- psicológicas, lo que se acercaría más al concepto de somatización (Hospital de Vall d’Hebron), o si más bien obedecen a otras condiciones médicas subyacentes.
EL EJE INTESTINO-CEREBRO
Resumiendo todo lo visto hasta el momento, una manera de ver el papel del estrés y los factores psicosociales en el SII, y los trastornos funcionales digestivos en general, es el modelo de la diátesis (vulnerabilidad) – estrés (2015).
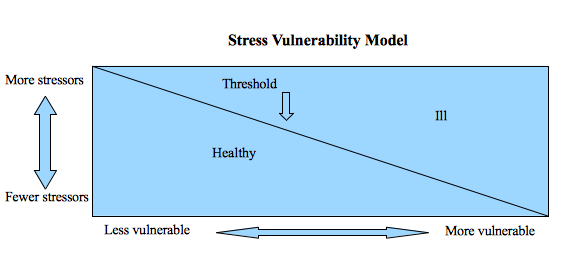
A mayor vulnerabilidad, es decir, a mayor predisposición (por genética, hábitos de vida, alimentarios, enfermedades concomitantes…) a desarrollar una enfermedad digestiva, menor cantidad de estrés será necesaria para desencadenarla. Y cuanto menor sea esta vulnerabilidad, mayor cantidad de estrés será necesaria para disparar la enfermedad. En la sociedad de hoy, el estrés es inescapable, y es imperativo aprender a convivir con él, manejándolo dentro de lo que a cada uno le permitan sus obligaciones (tener una buena calidad del sueño, apoyo social, tiempo para hobbies, actividad física, lo que podamos hacer para relajarnos con los recursos que tengamos a nuestro alcance). Del mismo modo, aunque a día de hoy no podemos cambiar nuestra vulnerabilidad genética, sí podemos intentar modificar algunos hábitos de vida u otros elementos que nos hacen tener una mayor vulnerabilidad (dieta sana/adaptada en lo posible, ejercicio en lo posible, mantener controladas otras enfermedades o condiciones que podamos tener, no tomar antibióticos innecesariamente…) siempre dentro de las posibilidades de cada uno.
Ya hemos enumerado los diversos efectos que el estrés puede tener en el SII y los trastornos funcionales digestivos, pero sería interesante conocer un poco mejor la manera exacta en la que influye en la salud de estos pacientes. Un estudio experimental de 2014 encontró que los pacientes con SII presentan una respuesta sostenida del eje hipotalámico-pituitario-adrenal (HPA, también llamado eje hipotalámico-hipofisario-adrenal o HHA) al exponerlos a estresores psicosociales agudos, segregando más cortisol (hormona del estrés), además de sufrir un empeoramiento de sus síntomas digestivos en los momentos posteriores a la situación estresante. Otro artículo, de «Frontiers in Systems Neuroscience», de 2018, nos ofrece un gráfico donde se representa la interacción del eje HPA con el dolor visceral:
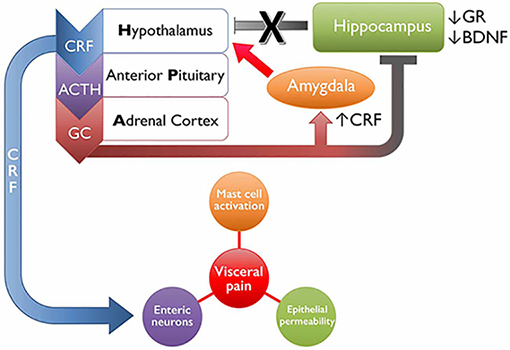
La figura busca representar el efecto de las experiencias tempranas de estrés en el eje HPA, induciendo cambios en la regulación límbica y las dianas fisiológicas internas. Normalmente el eje funciona de esta manera:
- Ante un estresor agudo, el hipotálamo produce el Factor Liberador de Corticotropina (CRF), que da la señal a la pituitaria/hipófisis anterior para que comience a segregar la hormona corticotropina.
- La circulación de corticotropina por todo el cuerpo activa las glándulas suprarrenales, que segregan glucocorticoides (cortisol).
- Normalmente, cuando el estresor desaparece, este sistema se retroalimenta negativamente para reducir los niveles de estas hormonas (el cortisol y el CRF se unen a receptores específicos del eje HPA y de ciertas estructuras límbicas, como la amígdala y el hipocampo, devolviendo al sistema a la homeostasis).
Sin embargo, ya vimos en el estudio anterior que esta respuesta parece prolongarse más de lo normal en pacientes con SII, y en este estudio de Frontiers se propone que una posible razón es el estrés temprano (infancia), que podría alterar el mecanismo descrito en el punto 3, al aumentar la producción de CRF desde el la amígdala y el hipotálamo, y reducir los receptores de glucocorticoides (GR) y los niveles de factor neurotrófico derivado del cerebro (BDNF) en el hipocampo.
Pero, ¿qué relación tiene todo esto con los síntomas del SII? Como se ve en la figura, el CRF actúa en algunas dianas moleculares que son clave en el SII. El CRF puede unirse a receptores específicos de los mastocitos, aumentando la activación/degranulación de éstos y la consiguiente liberación de mediadores pro-inflamatorios, puede unirse a neuronas entéricas que aumentan la motilidad colónica (las diarreas por «nervios»), y puede aumentar la permeabilidad epitelial afectando a las proteínas de unión estrecha (es un efecto de la degranulación mastocitaria). Estos mecanismos, que describimos con más detalle en el apartado «Microinflamación y permeabilidad», parecen estar presentes no sólo en el SII sino también en trastornos de dolor visceral de zonas anatómicas anexas, como la cistitis intersticial, el dolor pélvico crónico, o la vulvodinia (2018).
Las alteraciones del eje HPA son una muestra de cómo los factores psicológicos pueden tener consecuencias fisiológicas en los pacientes de SII. Sumado a toda la evidencia presentada, es innegable que nuestro cerebro y nuestro intestino están conectados, aunque en unos pacientes esta conexión sea más marcada y en otros menos. El modelo teórico predominante en la actualidad se basa precisamente en esta relación, entendiendo al SII como un trastorno donde las conexiones nerviosas entre intestino y cerebro están alteradas, modelo que recibe el nombre de «eje intestino-cerebro». Es más, la Rome Foundation comenzó a utilizar tras la publicación de los criterios de Roma IV (2016) el término «trastornos de la interacción intestino-cerebro» para referirse a los hasta entonces denominados como «trastornos funcionales digestivos» (aunque a efectos prácticos, la mayoría de círculos profesionales sigue utilizando el término «funcional»). Al inicio del apartado sobre «Alteraciones neurológicas» se puede encontrar más información sobre el eje intestino-cerebro.
